Actual
Lactato y fuerza muscular como indicadores de eficacia del entrenamiento en población con riesgo cardíaco
Mauricio Tauda1, Eduardo Cruzat1, Felipe Suarez11 Universidad Santo Tomas Sede Valdivia. Área de salud. Carrera Kinesiología
Resumen
Introducción: a forma tradicional de medir la fuerza es a través del 1Rm es una dinámica poco eficaz en pacientes en rehabilitación cardiaca. Objetivos: El objetivo de este estudio fue valorar la fuerza a través del lactato y determinar una carga especifica que permita desarrollar la fuerza en una zona aeróbica de moderada a baja intensidad en pacientes en riesgo cardiovascular. Materiales y Métodos: A través de muestreo no probabilístico intencional, 5 participantes hombres. Edad 48.80 ± 4.49. Peso 95.40 ± 5.54. Estatura, 1.74 ± 0.06. % Grasa 37.58 ± 2.68 % Masa muscular 38.62 ± 1.52. Vo2/kg 38.00 ± 2.73. min. Realizaron dos pruebas Resultados: Los resultados del análisis Anova no mostraron diferencias significativas entre los diferentes grupos en lactato F (4, 17.1) =0.524, p=0.720. Frecuencia cardiaca F (4, 16.4) =0.457, p=0.766. Los análisis post hoc la prueba de Tukey no mostraron diferencias entre las variables grupales. Frecuencia cardíaca (FC) media durante el ejercicio de fuerza de carga constante. 133.9/5.48 (Ppm). p=0.000. Concentraciones de lactato en sangre durante el ejercicio de Media 2.52/0.28. (Mmol/l). p=0.000. Carga constante 30/00 (kg). Los resultados indican que estas variables metabólicas y cardiacas se mantuvieron parcialmente estables en rangos energéticos aeróbicos. Dentro de la medición de las series 1, 3, 5, 7, 9, 11, 13, y 15. Conclusiones: Los valores obtenidos del test de carga constante muestran que las variables metabólicas y cardiorrespiratorias se mantienen estables en un metabolismo predominantemente aeróbico, esto podría sugerir que medir la fuerza a través del lactato es efectivo para entrenar la fuerza en pacientes con factores de riesgo cardiovascular
Palabras Clave: salud, condición física. pronostico. fuerza muscular. adulto
Abstract
Introduction: The traditional way of measuring strength through 1RM is an inefficient dynamic in patients undergoing cardiac rehabilitation. Objectives: The aim of this study was to assess strength through lactate levels and determine a specific load that would allow for strength development in a moderate to low intensity aerobic zone in patients at cardiovascular risk. Materials and Methods: Through intentional non-probabilistic sampling, 5 male participants were selected with the following characteristics: Age 48.80 ± 4.49, Weight 95.40 ± 5.54, Height 1.74 ± 0.06, Body Fat % 37.58 ± 2.68, Muscle Mass % 38.62 ± 1.52, VO2/kg 38.00 ± 2.73 min. They underwent two tests. Results: The results of the ANOVA analysis showed no significant differences between the different groups in lactate F (4, 17.1) = 0.524, p = 0.720. Heart rate F (4, 16.4) = 0.457, p = 0.766. Post hoc analyses using the Tukey test showed no differences between group variables. Mean heart rate during constant load strength exercise: 133.9/5.48 (bpm), p = 0.000. Blood lactate concentrations during exercise: Mean 2.52/0.28 (mmol/l), p = 0.000. Constant load: 30/00 (kg). The results indicate that these metabolic and cardiac variables remained partially stable within aerobic energy ranges during the measurement of sets 1, 3, 5, 7, 9, 11, 13, and 15. Conclusions: The values obtained from the constant load test show that metabolic and cardiorespiratory variables remain stable in a predominantly aerobic metabolism. This could suggest that measuring strength through lactate is effective for strength training in patients with cardiovascular risk factors.
Keywords: health, physical condition, prognosis, muscle strength, adult
INTRODUCCIÓN
La insuficiencia cardíaca es un síndrome clínico complejo que puede deberse a cualquier trastorno cardíaco estructural o funcional que afecte la capacidad del ventrículo para llenarse o expulsar sangre (Redfield y Borlaug, 2023). Las manifestaciones cardinales de la IC son la disnea y la fatiga, que pueden limitar la tolerancia al ejercicio, y la retención de líquidos, que puede provocar congestión pulmonar y edema periférico. Ambas anormalidades pueden afectar la capacidad funcional y la calidad de vida de los individuos afectados, pero no necesariamente dominan el cuadro clínico al mismo tiempo (Romero et al., 2022). La prevalencia en los países desarrollados se encuentra en torno al 1-2%, siendo >10% en mayores de 70 años. (OMS 2019). Las personas que padecen insuficiencia cardiaca crónica (IC) experimentan mala calidad de vida relacionada con la salud, mayor riesgo de mortalidad e ingreso hospitalario y altos costos de atención médica (Ferreira 2014; Ponikowski et al., 2014; Valdellos 2021). Sin embargo, la mortalidad por insuficiencia cardíaca está en declinación debido a los avances médicos, administración de medicamentos e intervenciones no farmacológicas. Una de estas intervenciones son los entrenamientos físicos, los cuales están siendo ampliamente aceptados por la comunidad médica como una opción viable en el manejo médico de pacientes con insuficiencia cardíaca permanente, además del manejo de los factores de riesgo comunes (ECNT) (Ezekowitz et al., 2017). Tanto los ejercicios aeróbicos como de fuerza han demostrado ser eficaces en este tipo de pacientes. En un nivel de evidencia A, recomendación clase 1 (AHA 2022). Para poder llevar a cabo las intervenciones a través del ejercicio físico en la IC es importante considerar una serie de variables: estadio de la IC, etiología, ICFER o ICFEP, clase funcional, síntomas predominantes, variables de laboratorio (función renal, electrolitos), hallazgos del ECG y expectativas de sobrevida (Asociación Americana de Rehabilitación Cardiovascular y Pulmonar. 2013; NYHA 2009; Sociedad Europea de Cardiología 2019; Sociedad Chilena de Cardiología y Cirugía Cardiovascular 2022). Esto asegura la adecuada estratificación del riesgo cardíaco y garantiza la seguridad del paciente ante la carga del ejercicio (Carvalho et al., 2020; Ögmundsdottir et al., 2020). Las manifestaciones de la IC, que limita la tolerancia al ejercicio, tienden al comportamiento sedentario, edad y enfermedad y potencian la discapacidad permanente y/o la necesidad de atención y la fragilidad (Hollmann 2007). Además, se ha encontrado que el >35% de los individuos de >65 años tienen evidencia de sarcopenia, lo que denota una pérdida excesiva de masa muscular, pérdida de fuerza, control y equilibrio muscular (Janssen, 2006; Kitzman et al., 2002). Estos factores afectan decisivamente la calidad de vida de los pacientes (Janssen et al., 2004; Latham et al., 2004). La pérdida de fuerza muscular está altamente correlacionada con la esperanza de vida en la insuficiencia cardiaca (Hülsmann et al., 2004). Para mantener la independencia funcional en la vejez y/o deterioro relacionado con la enfermedad, son necesarios niveles mínimos de fuerza y resistencia muscular para mantener la capacidad de realizar las actividades de la vida diaria (Hansen et al., 2022). Por lo tanto, el entrenamiento de la fuerza es una variable critica en rehabilitación cardíaca (Yamamoto et al., 2016). En este sentido la intensidad del entrenamiento de la fuerza es un factor crítico (Bingel et al., 2022; Blum et al., 2020). Este parámetro se debe cuantificar de manera específica y seria arriesgado aplicar la metodología clásica del 1RM (Cornelissen y Smart 2013). Actualmente existen diferentes formas de entrenar la fuerza en IC (Koch y Broustet 2020; Fletcher et al., 2012). Dado que no existe un protocolo específico para medir la fuerza en personas con factores de riesgo cardiovascular, se propone que el entrenamiento se realice a una intensidad por debajo del umbral anaeróbico.
De esta manera se puede reducir la carga sobre el sistema vascular y el gasto cardiaco disminuyendo los episodios de disnea y permitir que el paciente entrene en un metabolismo aeróbico constante. Es importante cuantificar de manera precisa este parámetro para una evaluación adecuada del estado físico de la persona y para el diseño de un programa de entrenamiento seguro y eficaz. Por lo tanto, el objetivo de este estudio fue valorar la fuerza a través del lactato y determinar una carga especifica que permita desarrollar este parámetro en una condición aeróbica en pacientes en rehabilitación cardiaca.
MATERIALES Y METODOS
Descripción de la muestra
Este estudio posee un enfoque cuantitativo y transversal, con un diseño cuasi experimental y un alcance descriptivo y correlacional. La muestra se seleccionó de la población del Gimnasio Podium Valdivia mediante un muestreo no probabilístico intencional, conformada por 5 hombres con una edad de 48.80 ± 4.49 años, un peso de 95.40 ± 5.54 kg, una estatura de 1.74 ± 0.06 m, un porcentaje de grasa corporal de 37.58 ± 2.68%, una masa muscular de 38.62 ± 1.52% y un VO2/kg de 38.00 ± 2.73 ml/kg/min. Todos los participantes firmaron el consentimiento informado de manera voluntaria. Las acciones relacionadas con la protección de los datos y la participación de los sujetos fueron revisadas y aprobadas por el Comité de Ética de la Universidad Santo Tomás, según la Resolución N° 23136643/2023.
Criterios de Selección de Participantes: Inclusión – Exclusión
Se incluyeron individuos que pertenecían al Gimnasio Podium Valdivia que no presentaban lesiones osteoarticulares, cirugías previas, experiencia en entrenamiento con carga, o antecedentes de enfermedades cardíacas o crónicas no transmisibles. Por otro lado, se excluyeron aquellos que no cumplían con los criterios de inclusión, así como aquellos con lesiones osteoarticulares, cirugías previas, experiencia en entrenamiento con carga, peso normal o sin antecedentes de enfermedades cardíacas o crónicas no transmisibles.
Antropometría
La evaluación antropométrica fue llevada en el laboratorio y según las normas de la sociedad internacional para el avance de la cineantropometría (Isak). Se realizó un perfil completo.
Análisis del VO2max.
El protocolo de medición directa sigue los lineamientos expuestos por Kokkinos et al. (2018). El cual inicio con un calentamiento de 10 minutos en la trotadora a 5 kph. con una inclinación de 0°. Al finalizar esta actividad la evaluación comenzó a 6 kph, con una duración de 1 min, inclinación constante de 1° y con aumentos progresivos de velocidad de 0.7 kph. hasta el agotamiento y con una fase de recuperación de 5 min a 4 kph. con inclinación 0. El analizador de gases ergo espirómetro Metalyzer Cortex 3B-R3, cinta rodante motorizada con capacidad máxima de 200 kg, modelo H/P/cosmos Mercury®
Prueba de fuerza incremental asociado al umbral anaeróbico
5 minutos de carrera en tapiz rodante a una velocidad de 6 kph. 5 minutos de ejercicios de movilidad articular y estiramientos dinámicos previos. Se efectuó un calentamiento específico de 3 serie de 10 repeticiones del miembro inferior y superior con una carga de 5 kilos. El ejercicio seleccionado fue sentadilla media. Que inicio con 10 kg. Repeticiones 15. Descanso 2 minutos entre series. Los aumentos de carga fueron de 5 kilos. Se recogieron muestras de sangre (5 µl). 30 s. después del final de cada paso de la prueba de carga incremental del lóbulo de la oreja. Este procedimiento se adoptó hasta que se alcanzaron los 4 Mol/litros. Dando fin a la prueba incremental. Posterior se realizó un trabajo regenerativo de 5 minutos en bicicleta.
Prueba de carga constante
El procedimiento de fuerza empleado sigue las directrices recomendadas por la National Strength and Conditioning Association (2016). Se llevó a cabo una prueba de carga constante con un valor de carga determinado según la media de los resultados obtenidos previamente. Este método se basa en el Protocolo de Fuerza Incremental diseñado para evaluar de manera sistemática la capacidad de resistencia y adaptación muscular.
El objetivo principal de esta prueba fue analizar el comportamiento y la estabilidad de diversas variables metabólicas y cardiorrespiratorias durante la ejecución del ejercicio. Para ello los participantes realizaron un total de 15 series compuestas por 15 repeticiones cada una. Entre cada serie se concedió un período de recuperación estándar de 2 minutos destinado a permitir la restauración parcial de las reservas energéticas y a minimizar la fatiga acumulada.
Durante la realización de la prueba se procedió a la toma de muestras de lactato sanguíneo en momentos específicos, concretamente después de las series 1, 3, 5, 7, 9, 11, 13 y 15. La medición del lactato sanguíneo es crucial para entender cómo se comporta el metabolismo anaeróbico durante el ejercicio de fuerza, proporcionando así información valiosa sobre el nivel de acidosis muscular y la capacidad de recuperación metabólica de los participantes.
Tabla 1. Análisis descriptivo de la muestra.
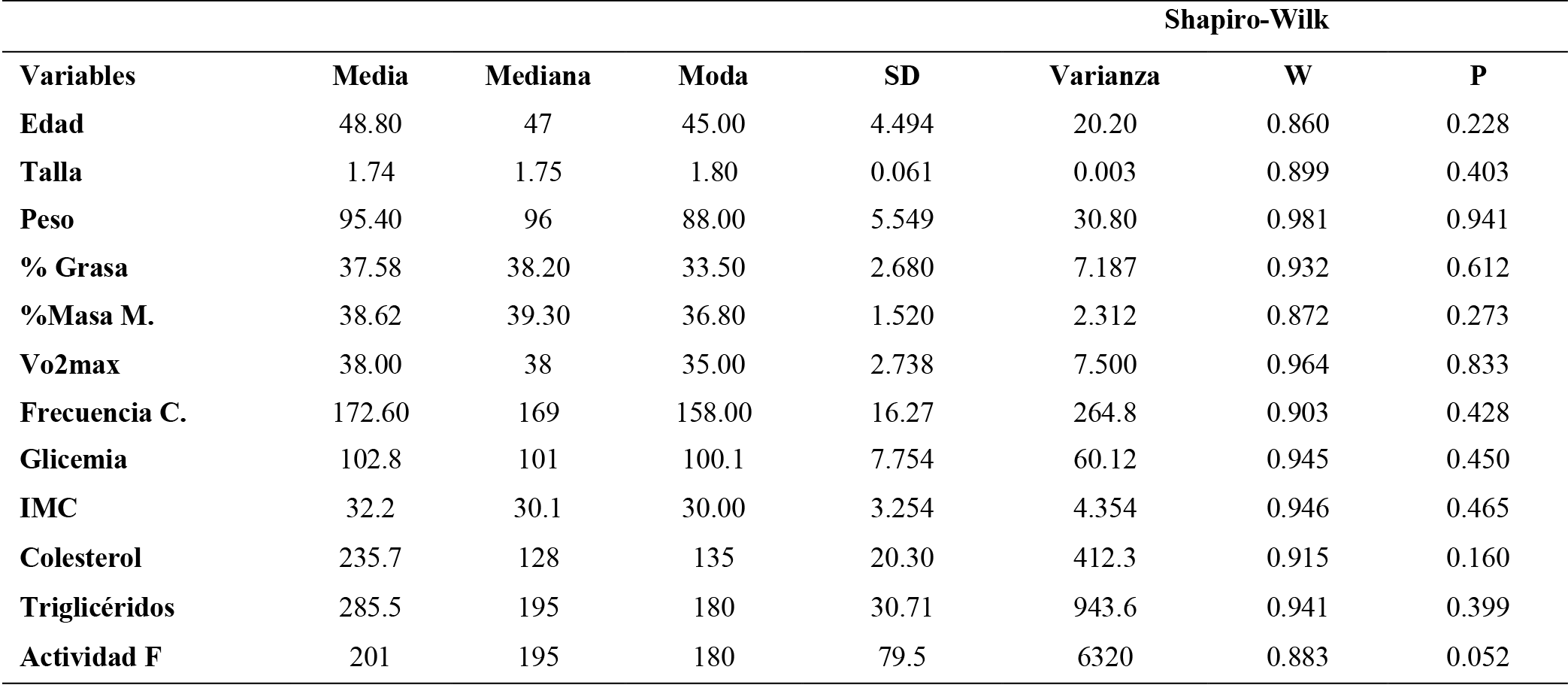
Nota: Características de los participantes del estudio (n5). Los datos son medias (±SD).
Análisis estadístico
El plan de análisis estadístico de los resultados incluyó las siguientes etapas. Estadística descriptiva: se realizaron cálculos de medidas de tendencia central y dispersión para describir los datos generales. Prueba de normalidad: se utilizó la prueba de Shapiro-Wilk para verificar si los datos seguían una distribución normal. Coeficiente de determinación R²: se evaluó la bondad de ajuste de las variables mediante este coeficiente. Prueba de correlación de Pearson: se utilizó esta prueba para analizar la relación entre las variables utilizadas y determinar si existe una asociación lineal entre ellas. Análisis de varianza ANOVA: se utilizó el ANOVA de un factor para detectar diferencias significativas en las variables cardiacas y metabólicas durante el ejercicio de carga constante. La prueba F se utilizó para evaluar estadísticamente la igualdad de las medias entre los grupos. Prueba de homogeneidad de Levene y prueba Kolmogorov-Smirnov. Para comprobar la igualdad de varianzas entre los grupos y la normalidad de los residuales. Prueba Post Hoc de Tukey: se utilizó esta prueba para comparar la variabilidad de los resultados entre grupos. Prueba t para muestras independientes: se utilizó esta prueba para comparar los datos registrados en el lactato y frecuencia cardíaca. Cálculo del tamaño del efecto (ES) y el poder estadístico (1-β): se determinó el tamaño del efecto para evaluar la magnitud de las diferencias encontradas y se calculó el poder estadístico para determinar la probabilidad de detectar una diferencia real entre los grupos. Software de análisis estadístico: se utilizó el programa Jamovi versión 18.0 (España) para realizar todas las pruebas estadísticas. Significancia estadística: se fijó un nivel de significancia de p < 0,05, lo que significa que se consideraron estadísticamente significativas las diferencias con un valor de p menor a este umbral. Presentación de resultados: todos los datos se expresaron como media (M) y desviación estándar (SD) en los análisis estadísticos.
RESULTADOS
Estratificación del riesgo cardíaco
La estratificación del riesgo cardíaco requiere una evaluación exhaustiva del estado clínico y funcional del paciente, que incluye tanto su historial médico como diversas pruebas físicas, de laboratorio y auxiliares. El objetivo principal es clasificar al individuo en diferentes niveles de riesgo, que pueden ser bajo, moderado o alto. En este estudio seguimos el protocolo recomendado por el Colegio Americano de Medicina Deportiva (ACSM) y la Asociación Estadounidense del Corazón (AHA) para la estratificación del riesgo cardíaco, siguiendo pautas actualizadas hasta el año 2020. Además de utilizar cuestionarios como el PAR-Q, también realizamos evaluaciones previas a la participación en centros de salud y fitness según los estándares de la AHA/ACSM. Como resultado de estas evaluaciones, los participantes fueron clasificados como inactivos y con factores de riesgo cardiovascular.
Tabla 2. Factores de riesgo de la muestra
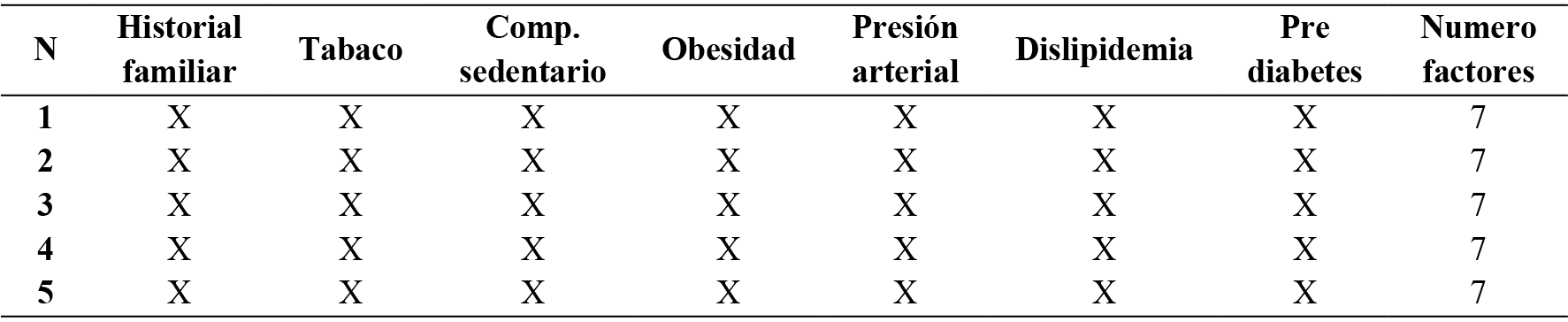
Nota: La tabla muestra la presencia o ausencia de diferentes factores de riesgo cardiovascular según las directrices de la ACSM 2020.
Tabla 3. Resultados ejercicio sentadilla media
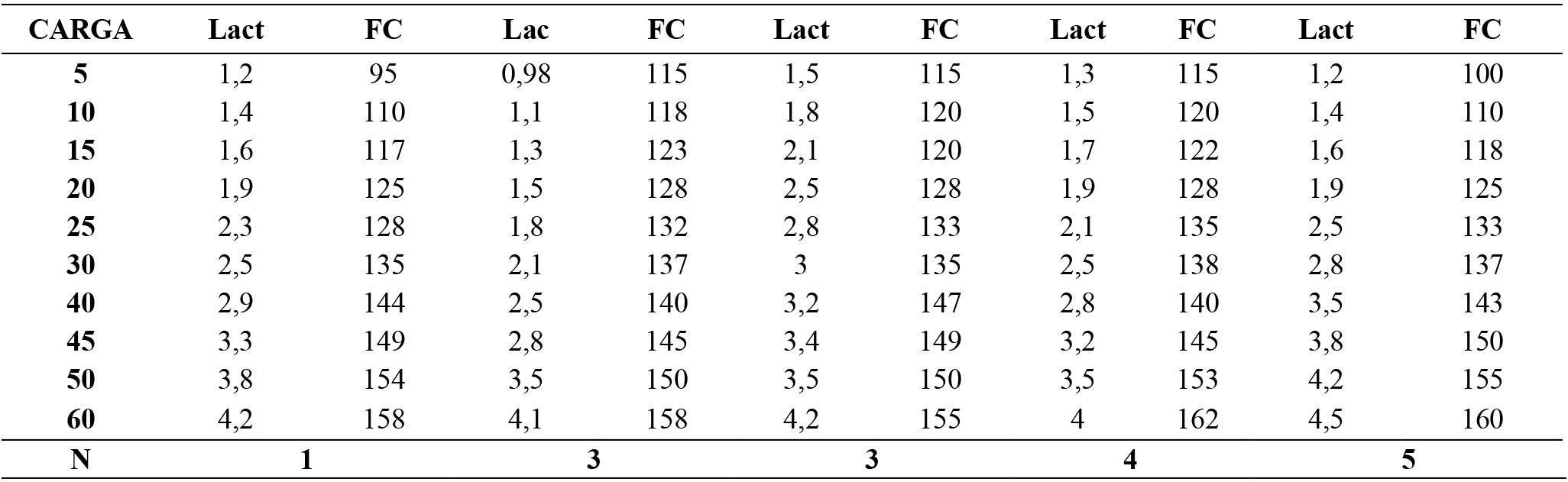
Nota: Resultados de la muestra, los datos cardiacos y metabólicos registrados a diferentes intensidades en la prueba de resistencia incremental hasta el Umbral anaeróbico. LAact=Lactato (Mmol/l ) FC=Frecuencia cardiaca (Ppm). Carga en kilogramos. (kg).
Tabla 4. Descripción de los resultados

Nota: Análisis descriptivo datos cardiacos y metabólicos, en la prueba de resistencia incremental hasta el Umbral anaeróbico. Lact=Lactato (Mmol/l ) FC=Frecuencia cardiaca (Ppm). Los datos son medias y (±SD). media general para el lactato 2.51/0.29 (Mmol/l). 134.6/1.15 (Ppm). Carga 30/00 (kg).
Tabla 5. Media grupal prueba incremental

Nota: La tabla representa el análisis descriptivo los datos generales. Media de los valores.
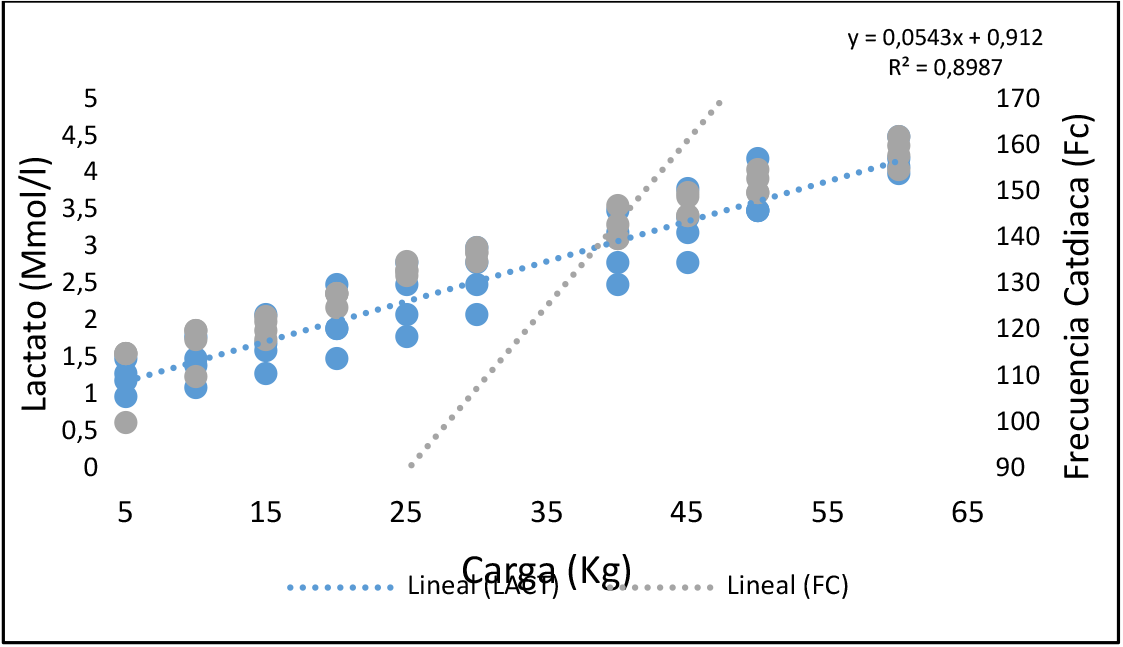
Figura 1. Prueba de resistencia incremental
La Figura 1 muestra relación de las variables determina, con un ajuste casi perfecto, R2. 0.8987. p=0.000. la variabilidad de los resultados expresa además la cinética del comportamiento del metabolismo energético y la frecuencia cardiaca ante cargas progresivas con una media general para el lactato 2.52/0.29 (Mmol/l). 133.5/1.15 (Ppm). Carga 30/00 (kg).
Prueba de ejercicio con carga constante
Para la aplicación de esta prueba se utilizó la carga media de los resultados de la prueba incremental 30 (kg). Durante 15 series de 15 repeticiones con descansos de 2 minutos entre cada serie. La toma de la muestra de lactato se tomó en la serie 1, 3, 5, 7, 9, 11, 13, 15.
Tabla 6. Resultados prueba incremental
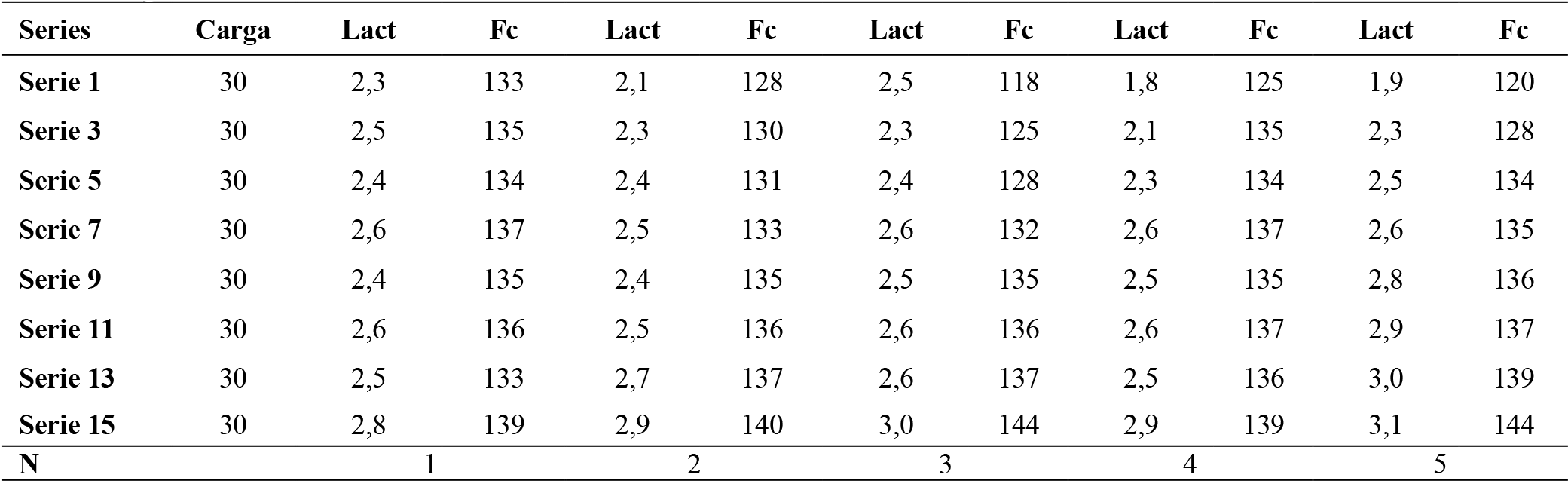
Nota: se llevó a cabo la prueba con la media de la carga total resultados del protocolo incremental 15 series de 15 repeticiones con 2 minutos de descanso entre series. la media grupal para el lactato 2.52 mmol/l. y frecuencia cardiaca. 133.95 ppm. Lac= lactato.(mmol/l) Fc= Frecuencia cardiaca. (Ppm)
Tabla 7. Resultados prueba carga constante
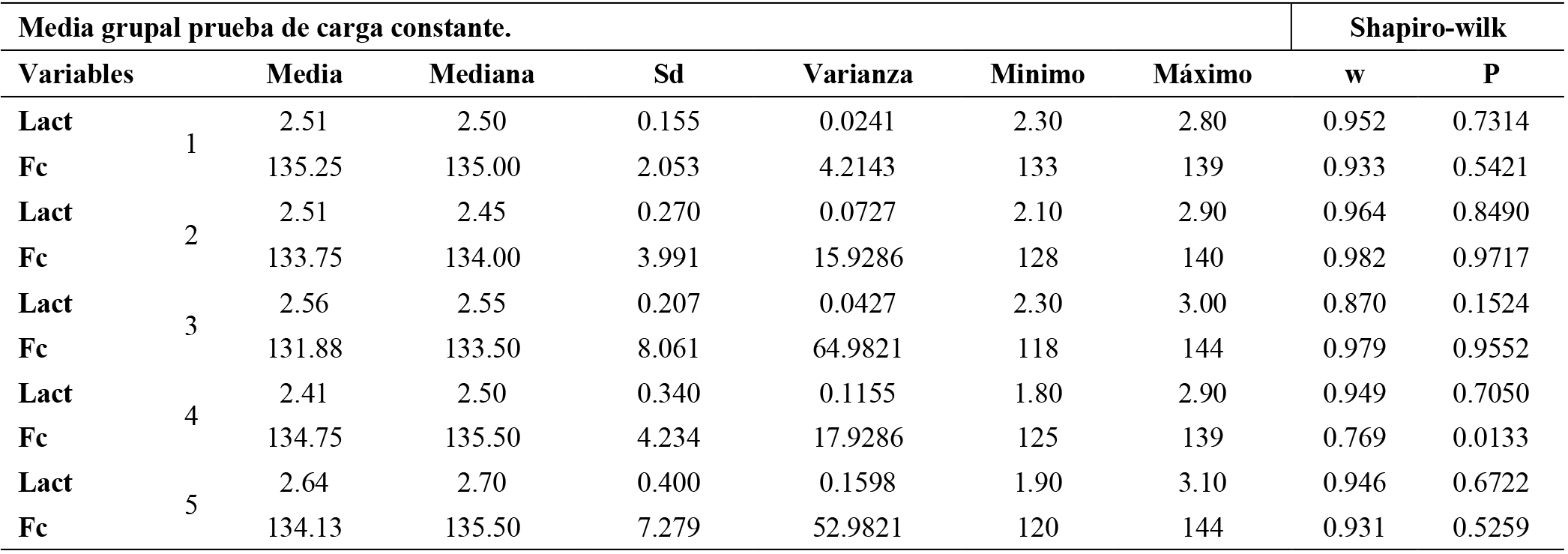
Nota: análisis descriptivo de los datos, se presentan la media de los valores. de los 5 sujetos más la normalidad de los datos. Lac= Lactato (mmol/l) Fc= Frecuencia cardiaca. (Ppm).
Tabla 8. Prueba T students carga constante
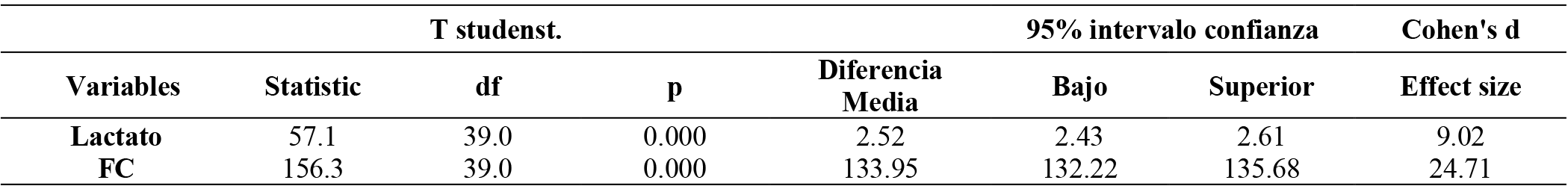
Nota: Media grupal para el lactato y frecuencia cardiaca, intervalo de confianza y efecto, (fc). frecuencia cardiaca. Lactato.(mmol/l) Fc= Frecuencia cardiaca. (Ppm).
Tabla 9. Correlación prueba carga constante

Nota: Correlación positiva Lactato (mmol/l) Fc=Frecuencia cardiaca. (Ppm).
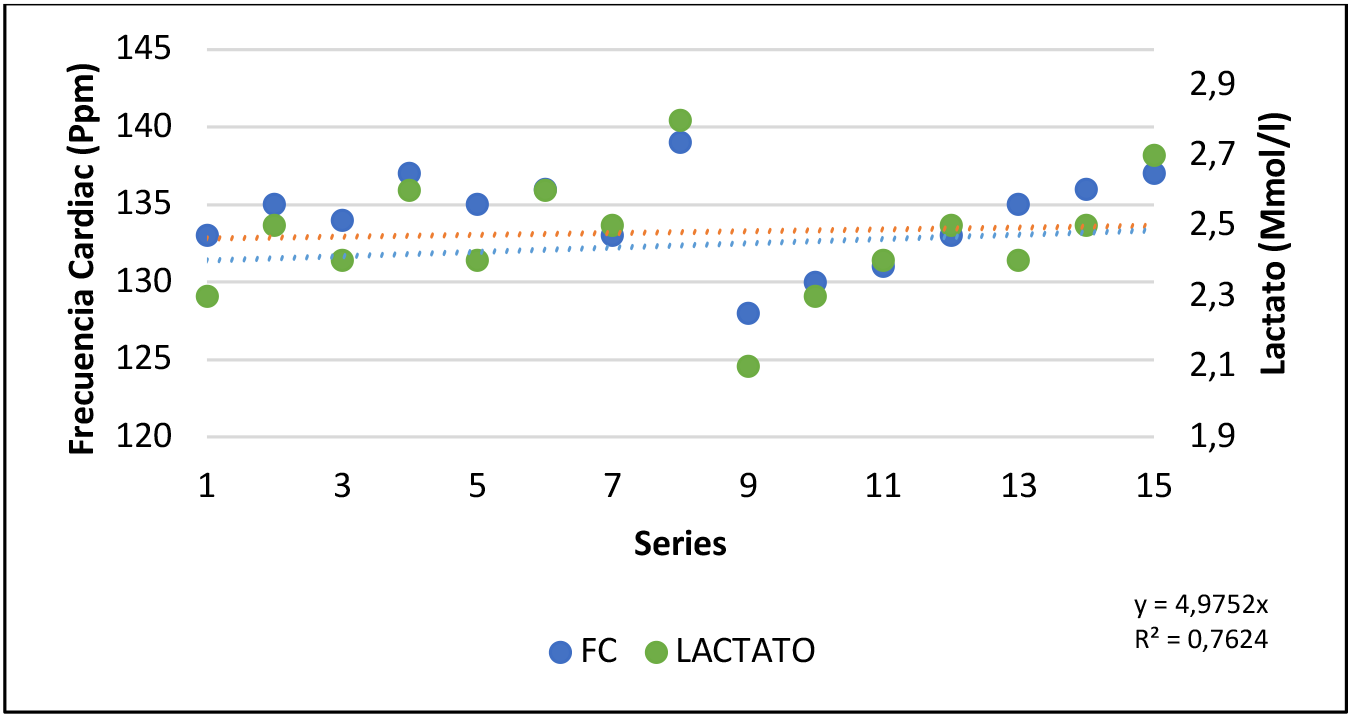
Figura 2. Relación de las variables con carga constante (n5).
Frecuencia cardíaca (FC) y Lactato (mmol/l) durante el ejercicio de fuerza de carga constante. carga media 30 kg. p=0.000.
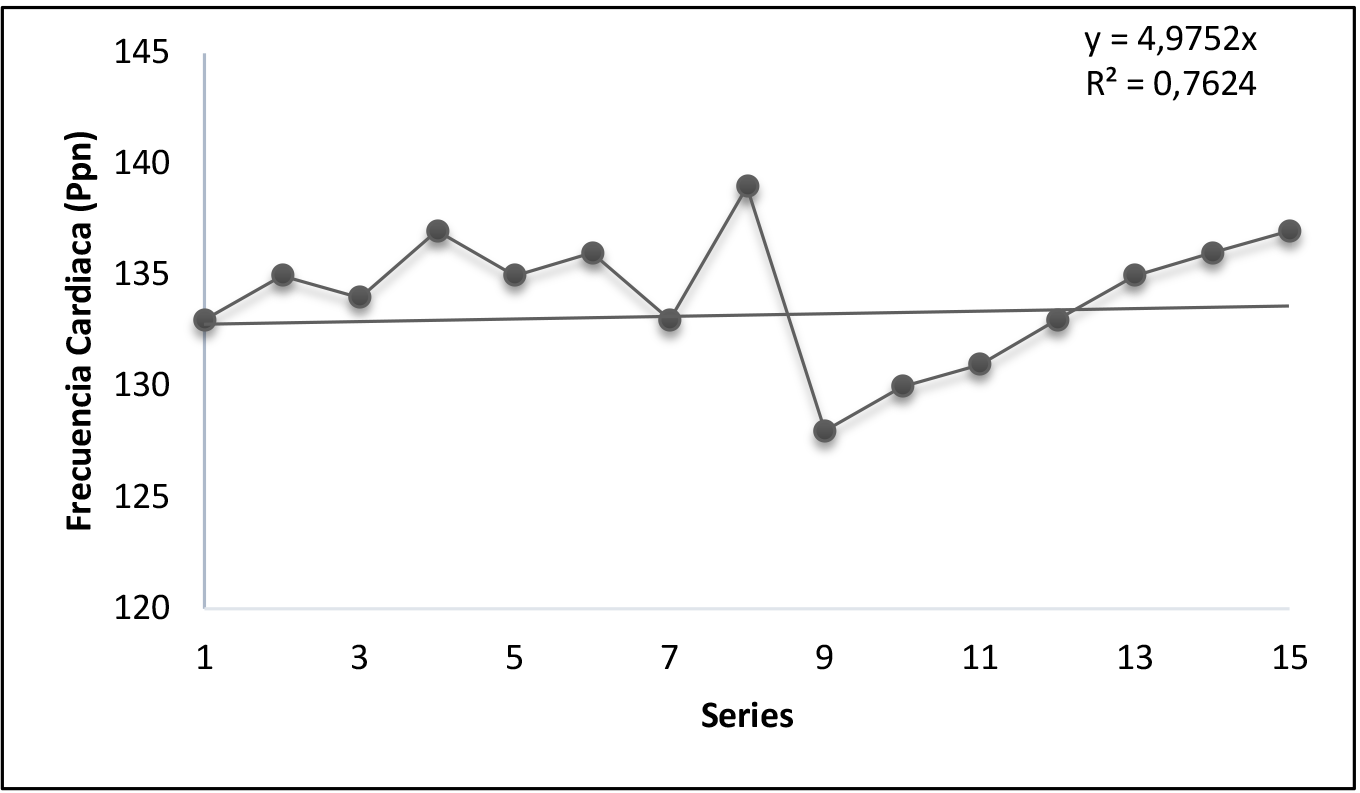
Figura 3. Ejercicio de carga constante (n5)
Frecuencia cardíaca (FC) Durante el ejercicio de fuerza de carga constante. 30 kg. Media de los valores 133.9/5.48 (Ppm). p=0.000.
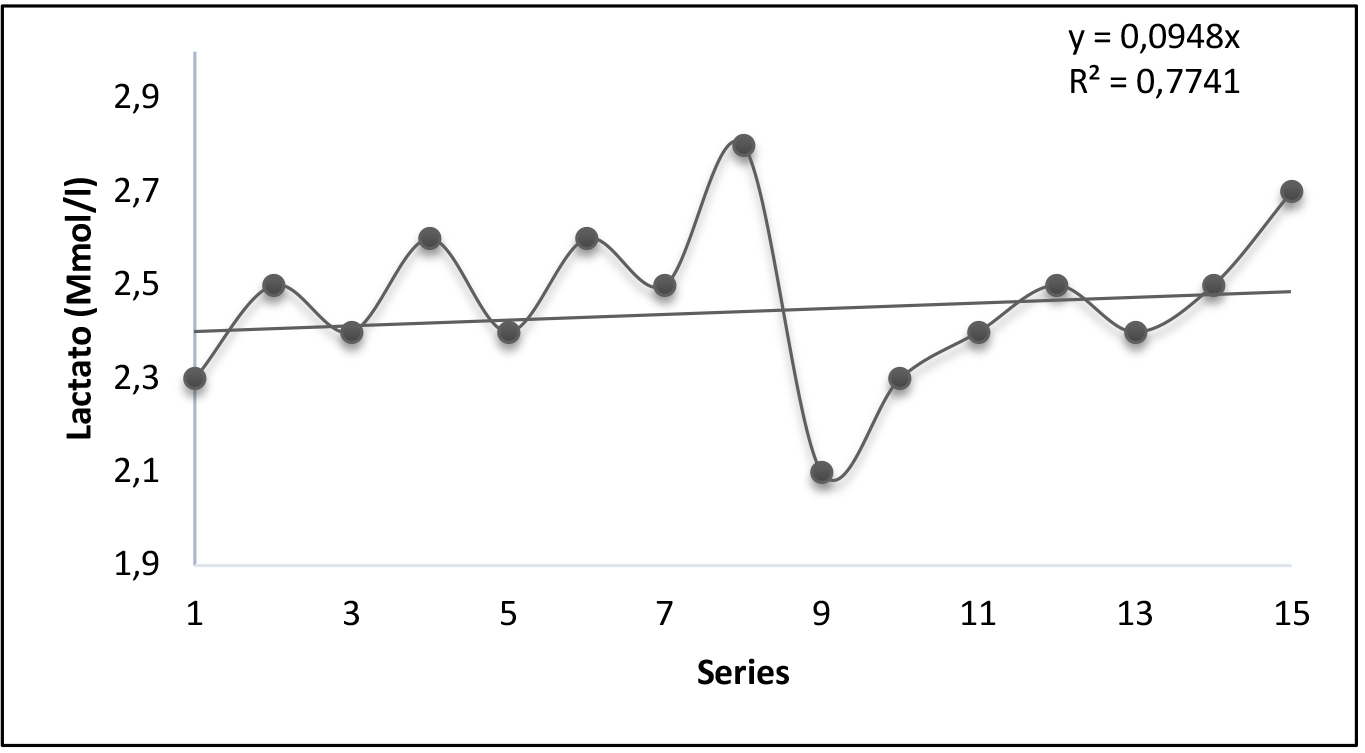
Figura 4. Ejercicio de carga constante (n5)
Concentraciones de lactato en sangre durante el ejercicio de fuerza de carga constante 30 (kg) Media 2.52/0.28 (mmol/l). p=0.000.
Tabla 10. Resultados Anova de una vía. (Fisher’s)

Nota: Resultados de la Anova de una vía y prueba F, además los supuestos de independencia test de Homocedasticidad con la prueba de Levene”s. y normalidad de los residuos estandarizados Prueba de Kolmogorov-Smirnov.
Los resultados presentados son los valores de prueba F para el análisis de varianza (ANOVA) de una vía en las variables de lactato y frecuencia cardíaca con los respectivos grados de libertad (df1 y df2) y valores de p.
Para la variable de lactato, el valor de prueba F es de 0.729, con 4 grados de libertad para el numerador (df1) y 35 grados de libertad para el denominador (df2) y un valor de p de 0.578.
Para la variable de frecuencia cardíaca, el valor de prueba F es de 0.430, con 4 grados de libertad para el numerador (df1) y 35 grados de libertad para el denominador (df2) y un valor de p de 0.786.
En ambos casos, los valores de p son mayores a 0.05, lo cual indica que no se encontraron diferencias significativas entre los grupos en ambas variables según el análisis de varianza realizado.
Tabla 11. Resultados Tukey Post-Hoc Test – Lactato

Nota: comparación de diferencias medias estimadas entre pares de grupos y los valores de p-valor correspondientes para el lactato.
Tabla 12. Resultados Tukey Post-Hoc Test –Frecuencia Cardiaca
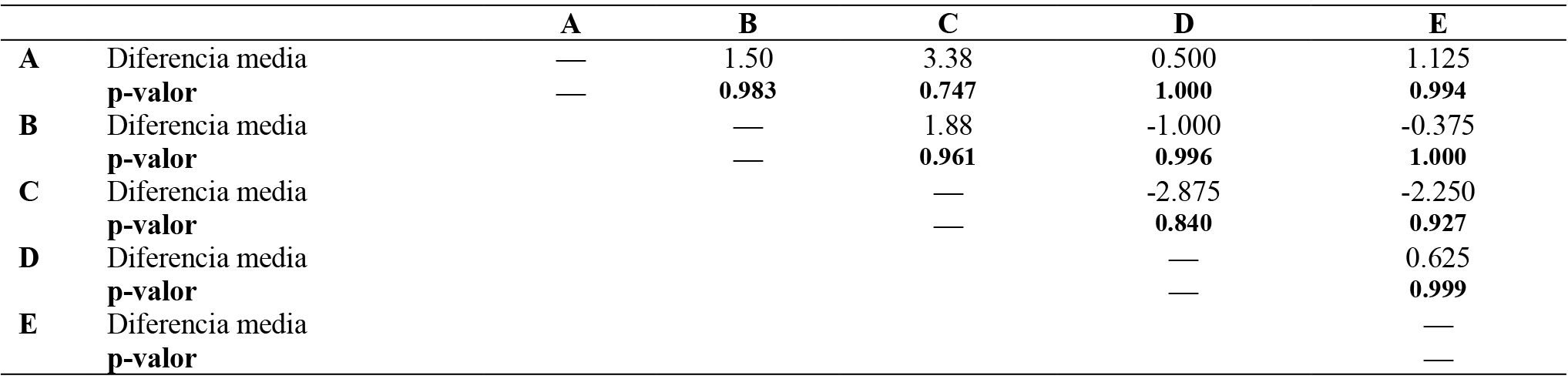
Nota: comparación de diferencias medias estimadas entre pares de grupos y los valores de p-valor correspondientes para Frecuencia cardiaca.
Estos resultados muestran las diferencias medias estimadas entre pares de grupos y los valores de p-valor correspondientes. Los valores de p-valor indican la significancia estadística de las diferencias medias estimadas. Si un valor de p-valor es menor que el umbral de significancia establecido (generalmente 0.05), se considera que hay una diferencia estadísticamente significativa entre los grupos en términos de los niveles de lactato y frecuencia cardiaca. Se puede interpretar de manera general que los resultados para los pares de grupos en función de los valores de p-valor que no hay una diferencia estadísticamente significativa en los niveles de lactato y frecuencia cardiaca entre los grupos.
DISCUSIÓN
El objetivo del estudio fue valorar la fuerza muscular a través del lactato y determinar una carga específica que permita desarrollar este parámetro en una condición aeróbica parcial en pacientes con factores de riesgo cardiovascular. Para alcanzar este objetivo se realizaron dos pruebas, la primera se ejecutó de manera progresiva. Los participantes realizaron 15 series de 15 repeticiones, con un tiempo de recuperación de 2 minutos entre cada serie. La toma de muestra de lactato se realizó en la serie 1, 3, 5, 7, 9, 11, 13 y 15. Se aumentó la carga en 5 kg para cada serie hasta el umbral anaeróbico. En la segunda etapa se utilizaron los valores medios de la prueba incremental (30 kg) para una prueba de carga constante. Durante 15 series de 15 repeticiones con descansos de 2 minutos entre cada serie. La toma de la muestra de lactato se tomó en la serie 1, 3, 5, 7, 9, 11, 13, 15. Se utilizó el ejercicio de sentadilla media, la velocidad de las fases de contracción concéntrica de 1 segundo y excéntrica de 1 segundo dentro del rango de flexión de 110º a 120º. El análisis descriptivo de las variables cardíacas y metabólicas en la prueba de esfuerzo incremental hasta el umbral anaeróbico indica que la cinética progresiva del lactato y la frecuencia cardíaca están influenciadas por la resistencia externa que condiciona los requerimientos energéticos de los individuos. La media global de lactato fue de 2,54/1,01 mmol/l, mientras que la media de frecuencia cardíaca fue de 134,68/15,38 ppm. La carga utilizada en la prueba fue de 30 kg y la puntuación de disnea fue de 2 a 3 en una escala de 0 a 10, lo cual indica un rango suave de percepción de disnea por parte del individuo. Al analizar las variables de forma independiente se determinó la relación entre ellas mediante el coeficiente de determinación R2, el cual fue de 0,8987 con un p-valor de 0,000. Esto confirma que existe una relación significativa entre el metabolismo energético medido a través del lactato y la frecuencia cardíaca durante la prueba de esfuerzo incremental bajo cargas progresivas. Esto permite evaluar la capacidad aeróbica y anaeróbica del individuo y sugiere que la resistencia externa utilizada en la prueba tiene un efecto importante en la cinética de estas variables.
Durante el ejercicio de fuerza con carga constante se observaron valores promedio de frecuencia cardíaca de 133.95/5.48 (ppm) y lactato 2.52/0.28 (mmol/l). Valores que se mantuvieron parcialmente estables en rangos energéticos aeróbicos durante la medición de las series 1, 3, 5, 7, 9, 11, 13 y 15. El tiempo total de ejecución fue de 450 segundos (30 segundos por serie) y el tiempo total de descanso fue de 16 minutos (2 minutos de pausa entre series), lo que resulta en un tiempo total de trabajo con carga constante en un metabolismo predominantemente aeróbico de 23.5 minutos. El hecho de que estas variables metabólicas y cardíacas se mantuvieran parcialmente estables indica que la intensidad del ejercicio era adecuada para sostener el metabolismo aeróbico. Es importante destacar que los valores de frecuencia cardíaca y lactato pueden variar según varios factores como la edad, el sexo, el nivel de condición física y el tipo de ejercicio realizado. Sin embargo, en general, una frecuencia cardíaca y lactato entre 133.95/5.48 (ppm) 2.52/0.28 (mmol/l) se considera una zona de trabajo aeróbico moderado (Abderrahman et al., 2018; Chicharro et al., 2013). En la prueba t de Student con carga constante los resultados indican que la diferencia media de lactato es de 2.52 (mmol/l), con un IC95% de (2.43-2.61) p-valor 0.000. Frecuencia cardíaca promedio es de 133.95 (ppm), con un IC95% de (132.22-135.68) p-valor 0.000. La prueba t de Student se utilizó para evaluar si estas diferencias son estadísticamente significativas en comparación con un grupo de control o una línea base. Los resultados de la prueba de correlación Pearson en la prueba de carga constante fue 0.758 p-valor 0.000. Diferencia media 2.61 IC95% (0.584-0.865).
Los resultados indican que hay una correlación positiva fuerte (0.758) entre las variables evaluadas. El intervalo de fianza indica que tenemos un 95% de confianza en que la verdadera diferencia media está dentro de este intervalo. Los resultados de la prueba F de la ANOVA en la prueba de carga constante indican que no se encontraron diferencias estadísticamente significativas en los niveles de lactato p-valor 0.578. Frecuencia cardíaca p-valor 0.786, lo que indica que no hay evidencia suficiente para rechazar la hipótesis nula de igualdad de medias entre los grupos (n5). Los resultados de las pruebas de homocedasticidad (prueba de Levene’s) para la variable lactato fue p-valor 0.1202. Lo que indica que no hay evidencia suficiente para rechazar la hipótesis nula de igualdad de varianzas entre los grupos (p > 0.05). Por lo tanto, se cumple el supuesto de homocedasticidad para la variable lactato. Prueba de normalidad de los residuos estandarizados (Prueba de Kolmogorov-Smirnov) p-valor 0.844 (p> 0.05) que indica que no hay evidencia suficiente para rechazar la hipótesis nula de normalidad de los residuos estandarizados de la variable lactato en los grupos. Por lo tanto, se cumple el supuesto de normalidad para la variable lactato. Los resultados de las pruebas de homocedasticidad (prueba de Levene’s) para la variable Frecuencia cardiaca fue p-valor 0.0778. Lo que indica que no hay evidencia suficiente para rechazar la hipótesis nula de igualdad de varianzas entre los grupos (p > 0.05). Por lo tanto, se cumple el supuesto de homocedasticidad para la variable lactato en este estudio. Prueba de normalidad de los residuos estandarizados (Prueba de Kolmogorov-Smirnov) p-valor 0.381 (p> 0.05) que indica que no hay evidencia suficiente para rechazar la hipótesis nula de normalidad de los residuos estandarizados de la variable lactato en los grupos. Por lo tanto, se cumple el supuesto de normalidad para la variable lactato. Los objetivos fundamentales del tratamiento de la IC son reducir los síntomas, mantener o mejorar la capacidad aeróbica, reducir la frecuencia de las hospitalizaciones y, en última instancia, prolongar la supervivencia manteniendo o mejorando la calidad de vida (Giuliano et al., 2022). Estos objetivos se pueden lograr mediante un enfoque de tratamiento multifacético que incluya farmacoterapia, terapia con dispositivos y rehabilitación con ejercicios (AACPR 2013). En este sentido, las guías de la American College of Cardiology (ACC), la American Heart Association (AHA) y la Heart Failure Society of America (HFSA) establecen dentro de los programas de rehabilitación cardiaca a los entrenamientos de resistencia y de fuerza como parte esencial de la atención secundaria (Grace 2023; Sjölin et al., 2020; Anderson et al., 2016). La OMS (2020) coincide en los lineamientos anteriores y se pronuncia en relación al volumen e intensidad y recomiendan acumular a lo largo de la semana un mínimo de entre 150 y 300 minutos de actividad física aeróbica de intensidad moderada, o bien un mínimo de entre 75 y 150 minutos de actividad física aeróbica de intensidad vigorosa, o bien una combinación equivalente de actividades de intensidad moderada y vigorosa, con el fin de obtener beneficios notables para la salud en esta población (Dibben et al., 2021). El American College of Sports Medicine establece que los programas de rehabilitación tienen que adaptarse a las capacidades y necesidades individuales de los pacientes, por lo tanto, la evaluación de la fuerza dirigida a la prescripción del ejercicio físico debe considerar la intolerancia al ejercicio, que a menudo se reduce severamente, en presencia de síntomas, como disnea y/o fatiga, que son el resultado de los mecanismos fisiopatológicos que determinan la IC (Salzano et al., 2021), tales como el deterioro en la reserva de volumen sistólico y la reserva cronotrópica, un aumento de la poscarga o la precarga, todo lo cual contribuye a la reducción del flujo del músculo esquelético (Caspi et al., 2020). Esta perfusión inadecuada, junto con la vasodilatación periférica dañada y la reducción de la extracción de oxígeno contribuye a un menor consumo máximo de oxígeno durante el ejercicio (Batt et al., 2014; Gan et al., 2018).
La disfunción del músculo esquelético en la insuficiencia cardíaca implica disminución de la masa muscular, alteraciones en la función contráctil del músculo esquelético, alteraciones en la tipificación de las fibras musculares esqueléticas, aumento de la grasa intermuscular, disfunción mitocondrial y anomalías bioenergéticas como los cambios bioquímicos, la capacidad oxidativa reducida, contenido de enzimas aeróbicas disminuido (Fleg, 2017; Liang et al., 2020; Phillips et al., 2015; Wannamethee et al., 2014; Weiss et al., 2017). La evidencia disponible sugiere que el componente muscular se encuentra en una situación crítica en los pacientes con IC (Fernández et al., 2022) ya que la masa muscular esquelética y la fuerza muscular y el equilibrio son componentes de la función física y son de particular importancia en los adultos mayores y juegan un papel importante en la realización de todas las actividades diarias (Laukkanen et al., 2007). Así mismo, es esencial para mantener la movilidad y la calidad de vida, es una característica sistémica importante de la fragilidad relacionada con la edad y tienen un impacto clínicamente relevante en la mortalidad, la morbilidad y la utilización de la atención médica (Wang et al., 2019). Como la debilidad muscular limita la capacidad aeróbica, la fuerza es un requisito previo para un ejercicio aeróbico eficaz (Lutz y Forman, 2022). Por lo tanto, las estrategias terapéuticas para atenuar esta condición recaen en los entrenamientos resistidos (Peçanha et al., 2017). El entrenamiento de la fuerza es la herramienta para romper este círculo vicioso, retrasar la aparición de estos cambios y disminuir su intensidad (Giuliano et al., 2017). Son claros los beneficios del ejercicio físico en IC. Principalmente los ejercicios de fuerza ya que pueden mejorar el metabolismo del músculo esquelético, la composición de la fibra muscular y pueden mejorar el flujo sanguíneo y la función vascular. Por lo tanto, mejorar la capacidad física, equilibrio muscular, coordinación y estabilidad, mejorando con esto la funcionalidad y calidad de vida (Lixandrão et al., 2018). Es cierto que el ejercicio de fuerza puede resultar en aumentos extremos de la presión arterial, pero este no es el caso para todas las cargas de este tipo. La respuesta real de la presión arterial al ejercicio de fuerza depende del componente isométrico, la intensidad del ejercicio (carga o resistencia utilizada), la masa muscular activada, el número de repeticiones en la serie y/o la duración de la contracción, así como la participación de la maniobra de Valsalva (Ambrosetti et al., 2021; Carbone et al., 2020). Si se prescribe el entrenamiento de la fuerza correctamente y se realiza con precisión, dosificado individualmente, supervisado médicamente y controlado por terapeutas deportivos experimentados, un ejercicio de resistencia dinámico, al menos para un cierto grupo de pacientes, no está asociado con mayores riesgos que un entrenamiento de resistencia aeróbico (Taylor et al., 2023). Actualmente no existe un consenso internacional sobre la prescripción de ejercicio o la duración del programa para RC y las recomendaciones de intensidad de ejercicio varían considerablemente entre países desde intensidad ligera a moderada (Niebauer et al., 2013; Piepoli et al., 2010; Woodruffe et al., 2015; Zores et al., 2019). En lo referente a la evaluación de fuerza, la evidencia actual propone evaluación a través de una repetición máxima (1Rm) y/o con ecuaciones que determinan un valor submaximo (Balady et al., 2007; Heidenreich et al., 2022; Piepoli et al., 2011). Actualmente no existen investigaciones que propongan al lactato como una forma de evaluar la fuerza en salud o en insuficiencia cardíaca, ya que tradicionalmente el lactato se ha utilizado principalmente como un indicador de fatiga muscular y de la capacidad aeróbica y no como una medida directa de la fuerza (Brooks, 2020). En resumen, la evaluación de la fuerza y el diseño de un programa de entrenamiento en pacientes con factores de riesgo cardiovascular deben ser personalizados y adaptados a las necesidades y capacidades individuales de cada paciente. Respecto a la propuesta de entrenar a una intensidad por debajo del umbral anaeróbico, esto puede ser una estrategia adecuada para reducir la carga cardiovascular y disminuir la aparición de síntomas como la disnea.
CONCLUSIONES
Aumentar la resistencia muscular, la coordinación intra e inter muscular y mejorar el metabolismo aeróbico, son los elementos críticos para la salud cardiovascular y la composición corporal en poblaciones sedentarias o con patologías relacionadas con el estilo de vida. En este sentido, los resultados de este estudio sugieren que la cuantificación de la fuerza a través del lactato puede ser efectivo para mantener estables las variables metabólicas y cardiorrespiratorias en un metabolismo predominantemente aeróbico, además permite evaluar la capacidad aeróbica y anaeróbica de un individuo.
Sin embargo, se deben considerar los resultados con cautela y tener en cuenta las limitaciones del estudio, como la pequeña muestra y el diseño no controlado de la investigación. Se necesitan más estudios para confirmar estos hallazgos y explorar la aplicabilidad de este protocolo de ejercicio en diferentes poblaciones y contextos de entrenamiento.
APLICACIÓN PRACTICA
La aplicación práctica de los hallazgos de este estudio podría ser en la evaluación y diseño de programas de entrenamiento para mejorar la salud cardiovascular y la composición corporal en poblaciones sedentarias o con patologías relacionadas con el estilo de vida.
LIMITACIONES
Es importante tener en cuenta que los resultados de cualquier estudio deben ser considerados con cautela y que se requieren múltiples investigaciones para validar los hallazgos y asegurar su aplicabilidad en diferentes poblaciones y contextos. En el caso de este estudio en particular, se menciona que la muestra fue pequeña y que el diseño no fue controlado, lo que sugiere la necesidad de realizar estudios con muestras más grandes y diseños más rigurosos. Además, se debe considerar que los efectos del ejercicio en la salud cardiovascular y la composición corporal pueden estar influenciados por múltiples factores como la edad, el género, la dieta, la genética y otros factores ambientales y de estilo de vida. Por lo tanto, se necesitan más estudios para validarlos y explorar su aplicabilidad en diferentes poblaciones y contextos de entrenamiento. Además, es importante adaptar el entrenamiento a las necesidades individuales y realizarlo bajo supervisión médica en pacientes con patologías cardiovasculares.
Referencias
1. Abderrahman, A. B., Rhibi, F., Ouerghi, N., Hackney, A. C., Saeidi, A., & Zouhal, H. (2018). Effects of recovery mode during High intensity Interval Training on glucoregulatory hormones and glucose metabolism in response to maximal exercise. Journal of Athletic Enhancement, 7(3). https:// doi.org/10.4172/2324-9080.1000292
2. Ambrosetti, M., Abreu, A., Corrà, U., Davos, C. H., Hansen, D., Frederix, I., Iliou, M. C., Pedretti, R. F. E., Schmid, J.-P., Vigorito, C., Voller, H., Wilhelm, M., Piepoli, M. F., Bjarnason-Wehrens, B., Berger, T., Cohen-Solal, A., Cornelissen, V., Dendale, P., Doehner, W., … Zwisler, A.-D. O. (2021). Secondary prevention through comprehensive cardiovascular rehabilitation: From knowledge to implementation. 2020 update. A position paper from the Secondary Prevention and Rehabilitation Section of the European Association of Preventive Cardiology. European Journal of Preventive Cardiology, 28(5), 460–495. https:// doi.org/10.1177/2047487320913379
3. American Association of Cardiovascular and Pulmonary Rehabilitation (2022). Guidelines for Cardiac Rehabilitation and Secondary Prevention Programs (6th ed. ). American Association of Cardiovascular and Pulmonary Rehabilitation.
4. Anderson, L., Oldridge, N., Thompson, D. R., Zwisler, A.-D., Rees, K., Martin, N., & Taylor, R. S. (2016). Exercise-based cardiac rehabilitation for coronary heart disease: Cochrane systematic review and meta-analysis. Journal of the American College of Cardiology, 67(1), 1–12. https:// doi.org/10.1016/j.jacc.2015.10.044
5. Balady, G. J., Williams, M. A., Ades, P. A., et al. (2007). Core components of cardiac rehabilitation/secondary prevention programs: 2007 update: a scientific statement from the American Heart Association Exercise, Cardiac Rehabilitation, and Prevention Committee, the Council on Clinical Cardiology;. the Councils on Cardiovascular Nursing, Epidemiology and Prevention, and Nutrition, Physical Activity, and Metabolism; and the American Association of Cardiovascular and Pulmonary Rehabilitation Circulation, 115(20), 2675–2682. https:// doi.org/10.1161/CIRCULATIONAHA.106.180945
6. Batt, J., Ahmed, S. S., Correa, J., Bain, A., & Granton, J. (2014). Skeletal muscle dysfunction in idiopathic pulmonary arterial hypertension. American Journal of Respiratory Cell and Molecular Biology, 50(1), 74–86. https:// doi.org/10.1165/rcmb.2012-0506OC
7. Bingel, A., Messroghli, D., Weimar, A., Runte, K., Salcher-Konrad, M., Kelle, S., Pieske, B., Berger, F., Kuehne, T., Goubergrits, L., Fuerstenau, D., & Kelm, M. (2022). Hemodynamic changes during physiological and pharmacological stress testing in patients with heart failure: A systematic review and meta-analysis. Frontiers in Cardiovascular Medicine, 9, 718114. https:// doi.org/10.3389/fcvm.2022.718114
8. Blum, M., Hashemi, D., Motzkus, L. A., Neye, M., Dordevic, A., Zieschang, V., Zamani, S. M., Lapinskas, T., Runte, K., Kelm, M., Kühne, T., Tahirovic, E., Edelmann, F., Pieske, B., Düngen, H.-D., & Kelle, S. (2020). Variability of myocardial strain during isometric exercise in subjects with and without Heart Failure. Frontiers in Cardiovascular Medicine, 7, 111. https:// doi.org/10.3389/fcvm.2020.00111
9. Brooks, G. A. (2020). Lactate as a fulcrum of metabolism. Redox Biology, 35(101454), 101454. https:// doi.org/10.1016/j.redox.2020.101454
10. Carbone, S., Billingsley, H. E., Rodriguez-Miguelez, P., Kirkman, D. L., Garten, R., Franco, R. L., Lee, D.-C., & Lavie, C. J. (2020). Lean mass abnormalities in heart failure: The role of sarcopenia, sarcopenic obesity, and cachexia. Current Problems in Cardiology, 45(11), 100417. https:// doi.org/10.1016/j.cpcardiol.2019.03.006
11. Caspi, T., Straw, S., Cheng, C., Garnham, J. O., Scragg, J. L., Smith, J., Koshy, A. O., Levelt, E., Sukumar, P., Gierula, J., Beech, D. J., Kearney, M. T., Cubbon, R. M., Wheatcroft, S. B., Witte, K. K., Roberts, L. D., & Bowen, T. S. (2020). Unique transcriptome signature distinguishes patients with heart failure with myopathy. Journal of the American Heart Association, 9(18), e017091. https:// doi.org/10.1161/JAHA.120.017091
12. Chicharro, D. J., Vicente, C., & Cancino, L. (2013). Fisiología del Entrenamiento Aeróbico. Una Visión Integrada. Editorial Panamericana.
13. Cornelissen, V. A., & Smart, N. A. (2013). Exercise training for blood pressure: a systematic review and meta-analysis. Journal of the American Heart Association, 2(1), e004473. https:// doi.org/10.1161/JAHA.112.004473
14. Dibben, G., Faulkner, J., Oldridge, N., Rees, K., Thompson, D. R., Zwisler, A.-D., & Taylor, R. S. (2021). Exercise-based cardiac rehabilitation for coronary heart disease. Cochrane Database of Systematic Reviews, 11(11), CD001800. https:// doi.org/10.1002/14651858.CD001800.pub4
15. Ezekowitz, J. A., O’Meara, E., McDonald, M. A., Abrams, H., Chan, M., Ducharme, A., Giannetti, N., Grzeslo, A., Hamilton, P. G., Heckman, G. A., Howlett, J. G., Koshman, S. L., Lepage, S., McKelvie, R. S., Moe, G. W., Rajda, M., Swiggum, E., Virani, S. A., Zieroth, S., … Sussex, B. (2017). 2017 comprehensive update of the Canadian cardiovascular society guidelines for the management of heart failure. The Canadian Journal of Cardiology, 33(11), 1342–1433. https:// doi.org/10.1016/j.cjca.2017.08.022
16. Fernández-Rubio, H., Becerro-de-Bengoa-Vallejo, R., Rodríguez-Sanz, D., Calvo-Lobo, C., Vicente-Campos, D., & Chicharro, J. L. (2022). Exercise training and interventions for coronary artery disease. Journal of Cardiovascular Development and Disease, 9(5), 131. https:// doi.org/10.3390/jcdd9050131
17. Ferreira-González, I. (2014). Epidemiología de la enfermedad coronaria. Revista Espanola de Cardiologia, 67(2), 139–144. https:// doi.org/10.1016/j.recesp.2013.10.003
18. Fleg, J. L. (2017). Exercise therapy for older heart failure patients. Heart Failure Clinics, 13(3), 607–617. https:// doi.org/10.1016/j.hfc.2017.02.012
19. Fletcher, B., Magyari, P., Prussak, K., & Churilla, J. (2012). Entrenamiento físico en pacientes con insuficiencia cardíaca. Revista médica Clínica Las Condes, 23(6), 757–765. https:// doi.org/10.1016/s0716-8640(12)70378-4
20. Gan, Z., Fu, T., Kelly, D. P., & Vega, R. B. (2018). Skeletal muscle mitochondrial remodeling in exercise and diseases. Cell Research, 28(10), 969–980. https:// doi.org/10.1038/s41422-018-0078-7
21. Giuliano, C., Levinger, I., & Woessner, M. (2022). Exercise for chronic heart failure. In Exercise to Prevent and Manage Chronic Disease Across the Lifespan (pp. 261–271). Elsevier.
22. Giuliano, C., Karahalios, A., Neil, C., Allen, J., & Levinger, I. (2017). The effects of resistance training on muscle strength, quality of life and aerobic capacity in patients with chronic heart failure - A meta-analysis. International Journal of Cardiology, 227, 413–423. https:// doi.org/10.1016/j.ijcard.2016.11.023
23. Grace, S. L. (2023). Evidence is indisputable that cardiac rehabilitation provides health benefits and event reduction: time for policy action. European Heart Journal, 44(6), 470–472. https:// doi.org/10.1093/eurheartj/ehac690
24. Mach, F., Baigent, C., Catapano, A. L., Koskinas, K. C., Casula, M., Badimon, L., … & ESC Scientific Document Group. (2019). Guía ESC/EAS 2019 sobre el tratamiento de las dislipemias: modificación de los lípidos para reducir el riesgo cardiovascular. Revista Española de Cardiología, 72(11), 925.e1-925.e78.
25. Guía ESC/EAS 2019 sobre el tratamiento de las dislipemias: modificación de los lípidos para reducir el riesgo cardiovascular. (2020). Revista espanola de cardiologia, 73(5), 403. e1-403.e70. https:// doi.org/10.1016/j.recesp.2019.10.031
26. Hansen, D., Mathijs, W., Michiels, Y., Bonné, K., Alders, T., Hermans, A., Copermans, K., Swinnen, H., Maris, V., Timmermans, I., Vaes, J., Govaerts, E., Reenaers, V., Frederix, I., Doherty, P. J., & Dendale, P. (2022). Phase III multidisciplinary exercise-based rehabilitation is associated with fewer hospitalizations due to adverse cardiovascular events in coronary artery disease patients. European Journal of Preventive Cardiology, 28(18), e17–e20. https:// doi.org/10.1093/eurjpc/zwaa038
27. Heidenreich, P. A., Bozkurt, B., Aguilar, D., Allen, L. A., Byun, J. J., Colvin, M. M., Deswal, A., Drazner, M. H., Dunlay, S. M., Evers, L. R., Fang, J. C., Fedson, S. E., Fonarow, G. C., Hayek, S. S., Hernandez, A. F., Khazanie, P., Kittleson, M. M., Lee, C. S., Link, M. S., … Yancy, C. W. (2022). 2022 AHA/ACC/HFSA guideline for the management of heart failure: Executive summary. Journal of the American College of Cardiology, 79(17), 1757–1780. https:// doi.org/10.1016/j.jacc.2021.12.011
28. Hollmann, W., Strüder, H. K., Tagarakis, C. V. M., & King, G. (2007). Physical activity and the elderly. European Journal of Cardiovascular Prevention and Rehabilitation: Official Journal of the European Society of Cardiology, Working Groups on Epidemiology & Prevention and Cardiac Rehabilitation and Exercise Physiology, 14(6), 730–739. https:// doi.org/10.1097/hjr.0b013e32828622f9
29. Hülsmann, M., Quittan, M., Berger, R., Crevenna, R., Springer, C., Nuhr, M., Mörtl, D., Moser, P., & Pacher, R. (2004). Muscle strength as a predictor of long-term survival in severe congestive heart failure. European Journal of Heart Failure, 6(1), 101–107. https:// doi.org/10.1016/j.ejheart.2003.07.008
30. Janssen, I. (2004). Skeletal muscle cutpoints associated with elevated physical disability risk in older men and women. American Journal of Epidemiology, 159(4), 413–421. https:// doi.org/10.1093/aje/kwh058
31. Janssen, Ian. (2006). Influence of sarcopenia on the development of physical disability: The cardiovascular health study: Influence of sarcopenia on disability. Journal of the American Geriatrics Society, 54(1), 56–62. https:// doi.org/10.1111/j.1532-5415.2005.00540.x
32. Kitzman, D. W., Little, W. C., Brubaker, P. H., Anderson, R. T., Hundley, W. G., Marburger, C. T., Brosnihan, B., Morgan, T. M., & Stewart, K. P. (2002). Pathophysiological characterization of isolated diastolic heart failure in comparison to systolic heart failure. JAMA: The Journal of the American Medical Association, 288(17), 2144–2150. https:// doi.org/10.1001/jama.288.17.2144
33. Koch, M., & Broustet, J.-P. (2020). Techniques de renforcement musculaire en réadaptation cardiaque. Archives des maladies du coeur et des vaisseaux. Pratique, 2020(289), 16–21. https:// doi.org/10.1016/j.amcp.2020.05.001
34. Kokkinos P, Kaminsky LA, Arena R, Zhang J, Myers J. (2018). Una nueva ecuación generalizada en cicloergometría para predecir el consumo máximo de oxígeno: el Registro de aptitud física y la base de datos nacional sobre la importancia del ejercicio (FRIEND). Revista Europea de Cardiología Preventiva, 25(10), 1077-1082. doi: 10.1177/2047487318772667
35. Latham, N. K., Bennett, D. A., Stretton, C. M., & Anderson, C. S. (2004). Systematic review of progressive resistance strength training in older adults. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences, 59(1), M48–M61. https:// doi.org/10.1093/gerona/59.1.m48
36. Laukkanen, J. A., Rauramaa, R., Salonen, J. T., & Kurl, S. (2007). The predictive value of cardiorespiratory fitness combined with coronary risk evaluation and the risk of cardiovascular and all-cause death. Journal of Internal Medicine, 262(2), 263–272. https:// doi.org/10.1111/j.1365-2796.2007.01807.x
37. Liang, H.-Y., Lo, Y.-C., Chiang, H.-Y., Chen, M.-F., & Kuo, C.-C. (2020). Validation and comparison of the 2003 and 2016 diastolic functional assessments for cardiovascular mortality in a large single-center cohort. Journal of the American Society of Echocardiography: Official Publication of the American Society of Echocardiography, 33(4), 469–480. https:// doi.org/10.1016/j.echo.2019.11.013
38. Lixandrão, M. E., Ugrinowitsch, C., Berton, R., Vechin, F. C., Conceição, M. S., Damas, F., Libardi, C. A., & Roschel, H. (2018). Magnitude of muscle strength and mass adaptations between high-load resistance training versus low-load resistance training associated with blood-flow restriction: A systematic review and meta-analysis. Sports Medicine (Auckland, N.Z.), 48(2), 361–378. https:// doi.org/10.1007/s40279-017-0795-y
39. Lutz, A. H., & Forman, D. E. (2022). Cardiac rehabilitation in older adults: Apropos yet significantly underutilized. Progress in Cardiovascular Diseases, 70, 94–101. https:// doi.org/10.1016/j.pcad.2022.01.001
40. Lloyd, R. S., Cronin, J. B., Faigenbaum, A. D., Haff, G. G., Howard, R., Kraemer, W. J., Micheli, L. J., Myer, G. D., & Oliver, J. L. (2016). Declaración de posición de la Asociación Nacional de Fuerza y Acondicionamiento sobre el desarrollo atlético a largo plazo. Journal of Strength and Conditioning Research, 30(6), 1491-1509. https:// doi.org/10.1519/JSC.0000000000001387
41. Ma, A., Hong, J., Shanks, J., Rudebush, T., Yu, L., Hackfort, B. T., Wang, H., Zucker, I. H., & Gao, L. (2019). Upregulating Nrf2 in the RVLM ameliorates sympatho-excitation in mice with chronic heart failure. Free Radical Biology & Medicine, 141, 84–92. https:// doi.org/10.1016/j.freeradbiomed.2019.06.002
42. Niebauer, J., Mayr, K., Tschentscher, M., Pokan, R., & Benzer, W. (2013). Outpatient cardiac rehabilitation: the Austrian model. European Journal of Preventive Cardiology, 20(3), 468–479. https:// doi.org/10.1177/2047487312446137
43. Oficial, S.-S. (2022). (December 6). Revista Chilena de Cardiología. Sochicar - Sitio Oficial; Sociedad Chilena de Cardiología y Cirugía Cardiovascular. https://sochicar.cl/publicaciones/revista-chilena-de-cardiologia/
44. Ögmundsdottir Michelsen, H., Sjölin, I., Schlyter, M., Hagström, E., Kiessling, A., Henriksson, P., Held, C., Hag, E., Nilsson, L., Bäck, M., Schiopu, A., Zaman, M. J., & Leosdottir, M. (2020). Cardiac rehabilitation after acute myocardial infarction in Sweden - evaluation of programme characteristics and adherence to European guidelines: The Perfect Cardiac Rehabilitation (Perfect-CR) study. European Journal of Preventive Cardiology, 27(1), 18–27. https:// doi.org/10.1177/2047487319865729
45. Organización Mundial de la Salud (2017). Assessing national capacity for the prevention and control of noncommunicable diseases. Organización Mundial de la Salud.
46. Organización Mundial de la Salud (2022). Assessing national capacity for the prevention and control of noncommunicable diseases: report of the 2019 global survey. Organización Mundial de la Salud.
47. Peçanha, T., Bartels, R., Brito, L. C., Paula-Ribeiro, M., Oliveira, R. S., & Goldberger, J. J. (2017). Methods of assessment of the post-exercise cardiac autonomic recovery: A methodological review. International Journal of Cardiology, 227, 795–802. https:// doi.org/10.1016/j.ijcard.2016.10.057
48. Pescatello, L. S., Wu, Y., Panza, G. A., Zaleski, A., & Guidry, M. (2020). Development of a novel clinical decision support system for exercise prescription among patients with multiple cardiovascular disease risk factors. Mayo Clinic proceedings. Innovations, quality & outcomes, 5(1), 193–203. https:// doi.org/10.1016/j.mayocpiqo.2020.08.005
49. Phillips, S. A., Vuckovic, K., Cahalin, L. P., & Baynard, T. (2015). Defining the system: Contributors to exercise limitations in heart failure. Heart Failure Clinics, 11(1), 1–16. https:// doi.org/10.1016/j.hfc.2014.08.009
50. Piepoli, Massimo F., Conraads, V., Corrà, U., Dickstein, K., Francis, D. P., Jaarsma, T., McMurray, J., Pieske, B., Piotrowicz, E., Schmid, J.-P., Anker, S. D., Solal, A. C., Filippatos, G. S., Hoes, A. W., Gielen, S., Giannuzzi, P., & Ponikowski, P. P. (2011). Exercise training in heart failure: from theory to practice. A consensus document of the Heart Failure Association and the European Association for Cardiovascular Prevention and Rehabilitation. European Journal of Heart Failure, 13(4), 347–357. https:// doi.org/10.1093/eurjhf/hfr017
51. Piepoli, M. F., Corrà, U., Benzer, W., Bjarnason-Wehrens, B., Dendale, P., Gaita, D., … & Schmid, J. P. (2010). Secondary prevention through cardiac rehabilitation: From knowledge to implementation. European Journal of Cardiovascular Prevention & Rehabilitation, 17(1), 1-17. https:// doi.org/10.1097/hjr.0b013e3283313592
52. Ponikowski, P., & Jankowska, E. A. (2015). Pathogenesis and clinical presentation of acute heart failure. Revista Española de Cardiología (English Ed.), 68(4), 331–337. https:// doi.org/10.1016/j.rec.2015.02.001
53. Redfield, M. M., & Borlaug, B. A. (2023). Heart failure with preserved ejection fraction: A review. JAMA: The Journal of the American Medical Association, 329(10), 827. https:// doi.org/10.1001/jama.2023.2020
54. Romero-Gómez, J. R., Tárraga-Marcos, L., Romero-Gomez, B., & Tárraga-López, P. J. (2022). Análisis del ejercicio físico en la Insuficiencia Cardíaca. Journal of Negative & No Positive Results, 7(1), 64–97. https:// doi.org/10.19230/jonnpr.4442.
55. Russell, S. D., Saval, M. A., Robbins, J. L., Ellestad, M. H., Gottlieb, S. S., Handberg, E. M., Zhou, Y., & Chandler, B. (2009). New York Heart Association functional class predicts exercise parameters in the current era. American Heart Journal, 158(4), S24–S30. https:// doi.org/10.1016/j.ahj.2009.07.017
56. Salzano, A., De Luca, M., Israr, M. Z., Crisci, G., Eltayeb, M., Debiec, R., Ranieri, B., D’Assante, R., Rega, S., D’Agostino, A., Mauro, C., Squire, I. B., Suzuki, T., Bossone, E., Guazzi, M., & Marra, A. M. (2021). Exercise intolerance in heart failure with preserved ejection fraction. Heart Failure Clinics, 17(3), 397–413. https:// doi.org/10.1016/j.hfc.2021.03.004
57. Sjölin, I., Bäck, M., Nilsson, L., Schiopu, A., & Leosdottir, M. (2020). Association between attending exercise-based cardiac rehabilitation and cardiovascular risk factors at one-year post myocardial infarction. PloS One, 15(5), e0232772. https:// doi.org/10.1371/journal.pone.0232772
58. Wannamethee, S. G., Shaper, A. G., Whincup, P. H., Lennon, L., Papacosta, O., & Sattar, N. (2014). The obesity paradox in men with coronary heart disease and heart failure: the role of muscle mass and leptin. International Journal of Cardiology, 171(1), 49–55. https:// doi.org/10.1016/j.ijcard.2013.11.043
59. Weiss, K., Schär, M., Panjrath, G. S., Zhang, Y., Sharma, K., Bottomley, P. A., Golozar, A., Steinberg, A., Gerstenblith, G., Russell, S. D., & Weiss, R. G. (2017). Fatigability, exercise intolerance, and abnormal skeletal muscle energetics in heart failure. Circulation. Heart Failure, 10(7). https:// doi.org/10.1161/CIRCHEARTFAILURE.117.004129
60. Woodruffe, S., Neubeck, L., Clark, R. A., Gray, K., Ferry, C., Finan, J., Sanderson, S., & Briffa, T. G. (2015). Australian Cardiovascular Health and Rehabilitation Association (ACRA) core components of cardiovascular disease secondary prevention and cardiac rehabilitation 2014. Heart, Lung & Circulation, 24(5), 430–441. https:// doi.org/10.1016/j.hlc.2014.12.008
61. World Health Organization (2020). Assessing national capacity for the prevention and control of noncommunicable diseases: Report of the 2019 global survey. World Health Organization.
62. Yamamoto, S., Hotta, K., Ota, E., Mori, R., & Matsunaga, A. (2016). Effects of resistance training on muscle strength, exercise capacity, and mobility in middle-aged and elderly patients with coronary artery disease: A meta-analysis. Journal of Cardiology, 68(2), 125–134. https:// doi.org/10.1016/j.jjcc.2015.09.005
63. Yancy, C., Jessup, M., Bozkurt, B. et al. (2013). ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. JACC, 62(16), e147–e239. https:// doi.org/10.1016/j.jacc.2013.05.019
64. Zores, F., Iliou, M.-C., Gellen, B., Kubas, S., Berthelot, E., Guillo, P., Bauer, F., Lamblin, N., Bosser, G., Damy, T., Cohen-Solal, A., & Beauvais, F. (2019). Physical activity for patients with heart failure: Position paper from the heart failure (GICC) and cardiac rehabilitation (GERS-P) Working Groups of the French Society of Cardiology. Archives of Cardiovascular Diseases, 112(11), 723–731. https:// doi.org/10.1016/j.acvd.2019.07.003
Cita en Kronos
Mauricio Tauda, Eduardo Cruzat Felipe Suarez (2024). Lactato y fuerza muscular como indicadores de eficacia del entrenamiento en población con riesgo cardíaco. . (23).https://g-se.com/lactato-y-fuerza-muscular-como-indicadores-de-eficacia-del-entrenamiento-en-poblacion-con-riesgo-cardiaco-3108-sa-267628dacef450
This post is also available in: Inglés
