Actual
Flujo Sanguíneo Cerebral Durante el Ejercicio de Esprint
David Curtelin1,2,3, Mario Perez-Valera1,2, Marcos Martin-Rincon1,2, Ismael Pérez-Suárez1,2, Evgenia D. Cherouveim4, Rafael Torres-Peralta1,2, José A. L. Calbet1,2, David Morales-Alamo1,21 Departamento de Educación Física, Universidad de Las Palmas de Gran Canaria, España
2 Instituto Universitario de Investigaciones Biomédicas y Sanitarias (IUIBS), Universidad de Las Palmas de Gran Canaria, España
3 Servicio de Urgencias, Complejo Hospitalario Universitario Insular-Materno Infantil de Las Palmas de Gran Canaria, Spain
4 Department of Sports Medicine and Biology of Exercise, Faculty of Physical Education and Sport Science, University of Athens, Athens, Greece
Resumen
<p>Se desconocen los efectos del entrenamiento interválico de alta intesidad (HIIT) sobre el flujo sanguíneo cerebral (FSC) y la oxigenación cerebral. Por ello reclutamos a 20 voluntarios que realizaron una sesión de HIIT (4 test de Wingate con recuperaciones de 4 minutos). Se midió la oxigenación del lóbulo frontal (OLF) y el Vastus lateralis (VL) a través de espectrofotometría cercana a los infrarrojos (NIRS). También se registró la velocidad de la sangre en las arterias cerebrales medias (vACM) mediante Doppler. La vACM disminuyó entre un 5 y 10 % en el primer esprint. En los siguientes esprints se redujo aún más. La vACM descendió en cada esprint coincidiendo con la disminución de la presión tele-espiratoria de dióxido de carbono (PETCO2) y con valores superiores de ventilación pulmonar (VE). Al interrumpirse el pedaleo se redujo bruscamente la vACM. Sin embargo, la OLF se mantuvo estable en el primer esprint sólo reduciéndose ligeramente durante el segundo y tercer Wingate (el cuarto fue similar al tercero). Este estudio muestra que la vACM disminuye durante los ejercicios de esprint, posiblemente debido a la hipocapnia. La reducción de la vACM no ejerce efectos funcionales ni relevantes sobre la oxigenación cerebral, gracias al ajuste de la conductancia vascular a través de los mecanismos de autoregulación, sin que parezca afectar negativamente al rendimiento.<br> <br> Trabajo financiado por VII Convocatoria de la Cátedra Fundación Real Madrid-Universidad Europea (2015/04RM).</p>
Palabras Clave: flujo sanguíneo cerebral, alta intensidad
Abstract
The effect of high-intensity interval training (HIIT) on cerebral blood flow (CBF) and cerebral oxygenation remain unknown. Therefore, we recruited 20 voluntaries who performed one HIIT session (4x30s Wingate tests with 4 minutes recovery between them). We measured frontal lobe (FLO) and Vastus lateralis (VL) oxygenation with NIRS. Middle cerebral artery blood flow velocity (MCAv) was measured by Doppler. MCAv decreased between 5 and 10 % during the first sprint. MCAv decreased slightly more during the subsequent sprints. Nevertheless, FLO remained stable during the first sprint and was only reduced slightly during the second and third Wingate (the fourth was similar to the third). MCAv decreased on each sprint with the reduction of End-tidal carbon dioxide pressure (PETCO2), the latter due to hyperventilation. When subjects stopped pedaling MCAv was dropped markedly. The decrease in MCAv did not produce any functional or relevant effect on frontal lobe oxygenation due to the adjustment of cerebral vascular conductance by the auto-regulatory mechanisms and did not seem to negatively affect performance.
Keywords: cerebral blood flow, high intensity
INTRODUCCIÓN
El ejercicio interválico de alta intensidad (HIIT) ha demostrado su superioridad en la prevención y tratamiento del síndrome metabólico y diversas enfermedades cardiovasculares y cerebrales (Burgomaster et al., 2008) , además de ser seguro en pacientes con enfermedad coronaria, insuficiencia cardíaca (Huang et al., 2014) y enfermedades pulmonares (Stefanelli et al., 2013) . Sin embargo, aún se desconocen los efectos fisiológicos, tanto del esprint como del HIIT, sobre la circulación cerebral.
Por tanto, ante el sensible auge del ejercicio físico y deporte en nuestros días, sumado al estilo de vida actual, en el que el tiempo libre es escaso y, viendo la evidencia de que mediante ejercicios de alta intensidad repetidos pueden lograrse mayores resultados en menor tiempo (Gillen & Gibala, 2014), resulta fundamental conocer los efectos fisiológicos y/o fisiopatológicos que ejercen los ejercicios de esprint sobre el organismo y en concreto sobre la regulación cerebrovascular.
La oxigenación cerebral es crítica, debido a la elevada demanda metabólica necesaria para mantener un adecuado funcionamiento neuronal y una comunicación intersináptica eficiente. El cerebro representa aproximadamente sólo el 2% del peso corporal total, pero sin embargo, recibe, en condiciones de reposo, entre el 15 y 20% del gasto cardíaco (GC). El flujo sanguíneo cerebral (FSC) total en un sujeto despierto y en reposo representa aproximadamente 50 mL·100 g-1 de tejido cerebral y a penas debería verse afectado por la activación fisiológica habitual o normal (Lassen, 1959). Sin embargo, cada vez existe mayor evidencia indicando que el FSC aumenta en las regiones con incremento de la actividad neuronal para suplir el aumento de la demanda metabólica (Rokamp et al., 2014; Yamaguchi, Kashima, Fukuba, & Hayashi, 2014) . Algunos estudios han demostrado aumentos regionales del FSC durante el ejercicio estático (ej. prehensión manual), tareas cognitivas o estímulos visuales (Rokamp et al., 2014; Yamaguchi et al., 2014) . La reserva fisiológica es considerable. El consumo de oxígeno del tejido cerebral representa 3,5 mL· 100 g-1 de tejido · min-1 y la extracción de oxígeno oscila entre 4 y 8 mL· dl-1 (Querido & Sheel, 2007), lo cual requiere en torno al 7-8% del GC en reposo.
El ejercicio de esprint se asocia en ocasiones con sensación de mareo, acompañada de síntomas neurovegetativos y vómitos o incluso síncope (Lacewell, Buck, Romero, & Halliwill, 2014), cuyas causas permanecen desconocidas. Una causa potencial es la reducción de la oxigenación cerebral secundaria a la disminución de la perfusión. Los determinantes primarios de la perfusión cerebral son, el gasto cardíaco, la presión arterial (PA) y la presión parcial de CCO2 (PaCO2) (Aaslid, Lindegaard, Sorteberg, & Nornes, 1989). Durante el esprint la PaCO2 desciende debido a la hiperventilación generada, mientras que la presión arterial sistólica (PAS) se incrementa sensiblemente (PAS>200 mmHg; Curtelin et al. datos no publicados), así como el GC. Es bien conocido que el descenso de la PaCO2 genera vasoconstricción (Lassen, 1959), causa por la que la hiperventilación se utiliza como medio para disminuir la presión intracraneal en pacientes neurocríticos, ya que la disminución de la perfusión, tal y como establece la doctrina del Monro Kellie, permite disminuir la presión intracraneal. La reducción de la perfusión cerebral puede verse contrarrestada por el incremento de la presión arterial media (PAM) en combinación con un mayor gasto cardíaco (Ogoh, Dalsgaard, et al., 2005) . Sin embargo, a pesar de la extensa literatura sobre la fisiología de la regulación de la perfusión cerebral, no existen estudios, que analicen las respuestas cerebrovasculares ante situaciones de esprint, probablemente por dificultades técnicas.
MÉTODO
Voluntarios
Tras aprobar el estudio el Comité de Ética de la Universidad de Las Palmas de Gran Canaria, se reclutaron 20 sujetos sanos estudiantes de Ciencias de la Actividad Física y del Deporte con las siguientes características (Edad:24±5 años; Peso: 76±9 kg; Porcentaje de grasa corporal: 18,8±5,1 %, Consumo máximo de oxígeno (VCO2max): 3,6±0,6 L · min-1). Una vez adquiridos los consentimientos informados se procedió a la realización del protocolo experimental.
Protocolo
Tras la evaluación médica inicial, los días previos al experimento los sujetos realizaron un test incremental hasta el agotamiento para determinar el VCO2max y una familiarización con los esprints de 30 segundos, así como las mediciones de composición corporal mediante absorciometría fotónica dual de rayos X (Lunar iDXA, General Electric, Wisconsin, USA).
- En la segunda visita al laboratorio se realizó el protocolo experimental detallado en la Fig. 1. Brevemente, los voluntarios llegaron al laboratorio tras un reposo de 24 horas y habiéndose abstenido de tomar bebidas estimulantes (cafeína, taurina, etc…) desde el día anterior al experimento. Posteriormente, se tumbaron sobre la camilla y se les colocaron optodos para mediciones de oxigenación tisular del vasto lateral y del lóbulo frontal, mediante espectrometría cercana a los infrarrojos (NIRS) espacialmente resuelta (NIRO 200, Hamamatsu, Japón). La velocidad de las arterias cerebrales medias fue medida a través de dos sondas de ecografía de 2MHz conectadas a un ecógrafo Doppler (Multi Box, DWL, Singen, Alemania). Posteriormente, los sujetos se sentaron en la camilla para tomar medidas basales en esta posición. Tras obtener los valores basales se les realizó un test de hiperventilación (THV) para establecer la relación entre la PETCCO2 y la vACM. A continuación, subieron al cicloergómetro para la realización de un calentamiento a 80 rpm con 3 cargas (2 min 60 W; 2 min 100 W y 1 min 150 W) 5 minutos de pedaleo a 20 W y 30 rpm hasta comenzar el primer Wingate. Se realizaron 4 test de Wingate de 30 s (isocinéticos a 80 rpm) con recuperaciones de 4 minutos. Se midió el lactato 1 minuto antes del primer test de Wingate, 30 segundos antes del segundo y a los 4 minutos de haber terminado el cuarto. En todos los test, un médico se encontraba presente.
Análisis Estadístico
Se determinó en primer lugar la distribución normal de las variables mediante el test de Shapiro-Wilk. La sensibilidad al CCO2 se determinó mediante regresión lineal, así como la relación entre variables. La comparación entre test de Wingate se realizó aplicando un test de ANOVA para medidas repetidas, mientras que las comparaciones por parejas se realizaron mediante el test de la t de Student para datos apareados, con corrección de Bonferroni-Holm para evitar la propagación de errores debidos a comparaciones múltiples. Los resultados se expresan como valores medios ± la desviación estándar. Se asumieron como significativas las diferencias con una probabilidad de ser debidas al azar inferior a P<0,05.
RESULTADOS
Sensibilidad al CCO2
- La sensibilidad al CCO2 fue comparable entre todos los sujetos. La relación fue lineal en todos con una pendiente media de b1=-1,466. Esto implica que por cada 1 mmHg que desciende la PETCCO2, la vmediaACM disminuye 1,47 cm·s-1. A menos que exista un deterioro de la autoregulación cerebral o que se sobrepusiese la actuación de otros mecanismos, este sería el comportamiento esperado ante cambios en la PaCO2.
Respuesta al ejercicio de esprint
Los sujetos alcanzaron entre el 77 y el 99% de los máximos observados en los test de esfuerzo incremental hasta el agotamiento, en las siguientes variables: frecuencia cardíaca (FC), ventilación pulmonar (VE), consumo de oxígeno (VCO2), producción de dióxido de carbono (VCCO2), equivalente ventilatorio para el oxígeno (VE/VCO2) y equivalente ventilatorio para el dióxido de carbono (VE/VCCO2).
Aunque los valores pico de ventilación se observaron al final del esprint, la presión tele-espiratoria de oxígeno (PETCO2) (Fig. 1A) alcanzó los valores máximos durante la primera mitad del test de Wingate, momento en el que la PETCCO2 alcanzó a su vez los valores mínimos, justo cuando el VCO2 se encontraba por encima del 80% y la FC por encima del 60%.
La velocidad del flujo en la arteria cerebral media siguió un patrón de disminución curvilíneo durante el esprint (R2>0,80, P<0,001) (Fig. 1B). La vACM se redujo casi un 10% al final del esprint con respecto a los valores registrados justo antes del mismo. Durante el esprint se observó una disociación entre los cambios en la vACM y los cambios en la PETCCO2 (Fig 1ª y 1B). La OLF medida con NIRS siguió un patrón similar, es decir, siguiendo un patrón curvilíneo (Fig.1C) (R2>0,97, P<0,001). Esto resultó en una reducción del índice de oxigenación tisular (TOI) (P<0,05). Sin embargo, mientras sólo se observa este ligero descenso en la oxigenación cerebral durante el esprint, la oxigenación del Vastus lateralis (Fig 1D) se redujo a valores mínimos en los primeros 15 segundos.
Respuesta Durante la Recuperación
En el primer minuto de la recuperación, la FC se redujo en más de 20 latidos por minuto. Al interrumpirse la actividad contráctil el VE y el VCO2 descendieron de forma brusca. A partir de ahí, durante los primeros 20-30 segundos de la recuperación la VE y el VCCO2 se mantuvieron casi constantes para posteriormente disminuir. El VCO2, sin embargo registró un descenso mucho más acentuado durante la recuperación, por lo que el cociente respiratorio (RER) aumentó durante el primer minuto post-esprint. Durante los primeros 20 segundos el VE/VCO2 se mantuvo estable en torno a 34 para posteriormente aumentar. No obstante, el VE/VCCO2 se mantuvo próximo a 27. A pesar de la estabilidad del VE/VCCO2, la PETCCO2 aumentó hasta el segundo 25 de la recuperación para posteriormente disminuir (Fig. 1A). La PETCO2 presentó una respuesta especular a los cambios observados en la PETCCO2 (Fig. 1A). Al finalizar el esprint la vACM cayó de forma brusca hasta valores un 10-20% inferiores a los del inicio del ejercicio (Fig 1B). A partir de entonces, aumentó progresivamente hasta alcanzar unos valores máximos por encima de 50 cm·s-1, unos 40 segundos tras el final del ejercicio, esto es, unos 15 después de alcanzar los valores pico de PETCCO2 observados durante la recuperación. Tras esto, descendió nuevamente hasta los valores previos al ejercicio. En general la oxigenación en el lóbulo frontal reprodujo el mismo patrón, exceptuando el abrupto descenso de la vACM finalizado el esprint, que no tuvo reflejo en la oxigenación cerebral, la cual se mantuvo en el nivel observado justo al momento de finalizar el ejercicio hasta los primeros 15 segundos de la recuperación (Fig 1C).
Resultados del Esprint Repetido
Los valores de VE al inicio del esfuerzo fueron mayores en el 2º, 3er y 4º esprint con respecto al primero. El VCO2 fue mayor durante el 2º y 3er esprint, pero un poco menor en el 4º con respecto del primero, no obstante, estas diferencias no fueron estadísticamente significativas. La VCCO2 en cambio se redujo ostensiblemente con la repetición de los esprints (P<0,05). En los esprint siguientes, la PETCCO2 parte de valores aún menores, reduciéndose durante el esprint hasta valores justo por encima de 20 mmHg (P<0,05). En consecuencia, la vACM fue más baja durante el 2º, 3er y 4º esprint, con respecto del primero (P<0,005).
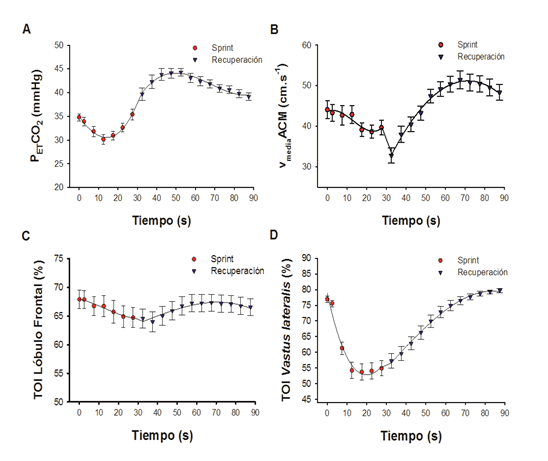
Figura 1. A) Evolución del PETCCO2 a lo largo del esprint y primer minuto de la recuperación, B) evolución de la velocidad de la sangre en la arteria cerebral media medida con doppler transcraneal durante el esprint y primer minuto de la recuperación, C y D) evolución del índice de oxigenación tisular mediante NIRS en el lóbulo frontal (C) y vasto lateral (D).
DISCUSIÓN
Durante el ejercicio de esprint ocurren cambios hemodinámicos y metabólicos agudos y muy marcados, que podrían influir en la oxigenación y el flujo sanguíneo cerebral. Los mecanismos de autorregulación han sido ampliamente estudiados tanto durante el ejercicio como en otras situaciones fisiológicas o incluso fisiopatológicas. Ello ha permitido caracterizar los diversos mecanismos que afectan a la regulación del FSC y la oxigenación del cerebro, aunque aún existen lagunas en cuanto a las relaciones entre los diversos mecanismos, su participación relativa, su sumación o la contrarregulación existente entre ellos, debido en parte a la dificultad y el riesgo de aislar cada mecanismo, bloqueando el resto. Importantes esfuerzos se han llevado a cabo para tratar de comprender cada mecanismo como una entidad aislada, pero existen actualmente evidencias de la estrecha interrelación de unos con los otros. Este proceso integrado de mecanismos reguladores y contrarreguladores, redundantes en ocasiones, permite proteger el cerebro, su parénquima y la barrera hematoencefálica, de efectos deletéreos que pudieran ser devastadores (Ogoh & Ainslie, 2009). Sin embargo, no consta que se hayan realizado estudios durante un estímulo, fisiológicamente hablando, tan intenso como el ejercicio de esprint, probablemente por dificultades técnicas. El hallazgo principal del estudio es que el FSC desciende, pero de forma independiente al descenso de la PaCO2. De hecho, durante la primera mitad de un esprint de 30 segundos la vmediaACM disminuye paralelamente al PETCCO2, pero este decremento persiste a pesar de la recuperación de los niveles CCO2 a sus niveles basales antes del final del esprint. De la misma manera, la oxigenación cerebral, medida como TOI mediante NIRS, sigue un patrón similar al flujo, reforzando la veracidad del hallazgo. Los datos aportan suficiente evidencia de que la vmediaACM no sigue directamente los cambios de la PETCCO2, a pesar de moverse en la misma dirección, al menos durante el inicio del esprint y de la recuperación. Este efecto es bastante más evidente durante los esprints posteriores donde siendo menor la potencia media, la respuesta ventilatoria es mayor. La oxigenación cerebral no se vio significativamente afectada a pesar de un mayor descenso de la vmediaACM en los sucesivos Wingates.
La PaCO2 se acepta generalmente como el estímulo más relevante en la regulación del FSC (Ainslie & Duffin, 2009). Estudios previos han mostrado que por cada mmHg que disminuye la PaCO2, el FSC disminuye entre un 1 y un 3% (Ide, Eliasziw, & Poulin, 2003). La hiperventilación genera hipocapnia (alcalosis respiratoria) que actúa como buffer de los H+ generados por la actividad muscular (Sakamoto, Naito, & Chow, 2014) . Este mecanismo ha sido propuesto como estrategia para mejorar el rendimiento ante esprints repetidos (Sakamoto et al., 2014). Los resultados de este estudio indican un decremento coincidente, en valores absolutos y durante la primera mitad del primer esprint, y una disminución aún mayor en los siguientes, si asumimos la PETCCO2 como un sustituto válido de la PaCO2 (Losa-Reyna, Torres-Peralta, Henriquez, & Calbet, 2015) . Sin embargo, debe valorarse con cautela, ya que los valores de PETCCO2 pueden constituir un factor de confusión, pues se ven ampliamente afectados por la activación de los centros respiratorios. Nuestros datos indican que a pesar de que los valores pico de ventilación alcancen su máximo al final del esprint la PETCO2 alcanzó sus valores máximos hacia la mitad del esprint, mientras la PETCCO2 alcanza en el mismo momento, sus valores mínimos. Esto indica una hiperventilación relativamente mayor en la fase inicial del esprint que al finalizar el test, o lo que es lo mismo, cerca del pico de potencia máximo. Este efecto, es posible que sea debido a la elevada estimulación de los centros respiratorios medulares a través de comandos centrales, mientras que al término del esprint, la VE se ajusta mejor a las respuestas esperadas en función de la VCCO2, como se refleja en los valores de VE/VCCO2 al finalizar el esprint. El retardo en la respuesta de la vACM es esperable teniendo en cuenta el tiempo de circulación, que es de unos 10 a 15 segundos a las frecuencias cardíacas del período de recuperación (Calbet, Mortensen, Munch, Curtelin, & Boushel, 2016) . Por otro lado, algunos estudios han mostrado que los cambios en el FSC precisan de unos 6 segundos en producirse, en respuesta a cambios en el CCO2 (Ide et al., 2003). Por todo ello, sin negar el importante rol del CCO2 como estímulo productor de cambios en el FSC, podemos afirmar que no se trata del estímulo preponderante en nuestras condiciones experimentales.
El oxígeno también puede, a priori, considerarse un estímulo fundamental. Sin embargo, debemos apuntar dos condiciones. En primer lugar, en presencia de hipocapnia, la sensibilidad a la hipoxia se ve ampliamente mermada (Mardimae et al., 2012) , mientras que en condiciones de isocapnia la hipoxia es un potente vasodilatador que aumenta el FSC (Ainslie & Ogoh, 2010). Sin embargo, se sabe que para que la hipoxia ejerza su efecto sobre el tono de las arterias cerebrales y secundariamente incremente el FSC, la PaCO2 debe disminuir hasta valores de 50 mmHg o bien SaCO2 del 80% (Ainslie & Ogoh, 2010). Durante los 30 segundos de duración del esprint no se alcanzan, ni mucho menos, dichos valores, y tampoco tras la repetición de los esprints. Por otro lado, cualquier ligero efecto atribuible a la disminución de la oxigenación tisular en nuestras condiciones experimentales quedaría contrarrestada por el incremento de la respuesta ventilatoria y la hipocapnia resultante (Ainslie & Ogoh, 2010). Es más, asumiendo que las variaciones en los valores del NIRS obtenidos de los canales cerebrales son comparables a los musculares, y sabiendo, a su vez que una reducción en 20 puntos del TOI del Vastus lateralis equivale (por Método de Fick) a un cambio de aproximadamente un 85% en la extracción de oxígeno, podemos estimar que la extracción al final del esprint estaría incrementada en un 16%, lo que resulta suficiente para compensar el decremento observado de la vACM. Finalmente, otros estudios han demostrado este incremento de la extracción (Rasmussen et al., 2007) , cuando el flujo sanguíneo cerebral desciende por hiperventilación o al respirar una mezcla hipóxica con una fracción inspiratoria de oxígeno (FiCO2) del 10% (Rasmussen et al., 2007) , basándose en que la intensa actividad metabólica cerebral debe generar algún grado de acidosis extracelular, que incluso en presencia de hipocapnia, facilite la extracción local de oxígeno. Por todo ello, asumimos que al menos durante los 30 segundos que dura el esprint en las condiciones experimentales de este estudio, la hipoxia no presenta un estímulo significativo en la regulación del FSC, al menos en pacientes sanos, aunque podría jugar un papel importante en altitud o en pacientes con enfermedades pulmonares o insuficiencia cardíaca (Ainslie & Ogoh, 2010).
Durante los escasos 30 segundos que dura el Wingate, se alcanzaron, rápidamente valores ergoespirométricos sorprendentemente cercanos al máximo. La actividad del comando central incrementa la FC, la VE, el VCO2, el VCCO2, la relación VE/VCO2, la VE/VCCO2, la presión arterial y el GC rápidamente. La actividad neuronal y el metabolismo cerebral y sistémico están sumamente elevados alcanzando valores superiores al 80% del VCO2max. Este incremento de las necesidades metabólicas debiera llevar aparejado un incremento de la perfusión (acoplamiento neurovascular) (Yamaguchi et al., 2014). Estudios recientes han demostrado aumentos locales, más que globales de la perfusión ante estímulos diversos como la prehensión manual, extensiones de rodilla de una sola pierna o estímulos visuales (Nogueira et al., 2013), mientras que otros apuntan a incrementos generalizados del FSC durante el ejercicio, al menos hasta alcanzar un consumo de oxígeno de ≈60% del máximo (Moraine et al., 1993). Por encima de dicho valor, el FSC no sólo no presenta mayor capacidad de incremento sino que retorna a valores de reposo (Moraine et al., 1993). Otros factores, tendentes al incremento del FSC serían el aumento de la presión arterial, tanto sistólica como diastólica y el GC, a pesar de una diminución de la relación entre estos parámetros y el FSC durante el ejercicio en comparación con el reposo (Ogoh, Brothers, et al., 2005) . Lucas et al. mostraron mediante un re-análisis de los datos de diversos estudios que el FSC debía incrementarse un 7% por cada 10 mmHg de aumento en la presión arterial media (PAM) y, por el contrario disminuir entre un 2 y un 7% por cada 10 mmHg de descenso de la PAM (Lucas et al., 2010) . Si este hecho fuera realidad en las condiciones de nuestro experimento, el aumento predicho de la presión de perfusión generaría un aumento tanto regional como global de la perfusión (Deegan et al., 2010) amenazando la integridad de la barrera hematoencefálica. Teniendo en cuenta los factores que debieran incrementar el FSC y que la PaCO2 ha sido descartada como principal factor, sorprende observar como durante el esprint de 30 segundos la vmediaACM disminuye en lugar de aumentar, reflejando la existencia de otros mecanismos que en las presentes condiciones son capaces de reducir el FSC como protección de la integridad de la barrera hematoencefálica.
Por otro lado, al finalizar el esprint, observamos un abrupto descenso del VCO2 que refleja probablemente una disminución paralela de la disponibilidad de CO2, a causa de la disminución del GC. Esto es debido a que el GC desciende exponencialmente con el cese de la actividad muscular (Davies, Di Prampero, & Cerretelli, 1972), conllevando un descenso de la perfusión de las piernas (Hermansen & Vaage, 1977) que depende directamente del mismo (Calbet & Lundby, 2012). El descenso del FSC en esta circunstancia viene a corroborar la relación existente a todos los niveles entre el GC y el FSC. Pero más aún, ofrece indicios de que, efectivamente, la autorregulación cerebral es más efectiva ante incrementos de presión (histéresis) (Ide et al., 2003) que ante descensos de la misma. El deterioro de la autoregulación cerebral dinámica pudiera estar en relación a la alteración del medio de los vasos cerebrales, asociado al flujo de metabolitos como el amonio o los H+ hacia el tejido vascular y en el líquido cefalorraquídeo, secundariamente al incremento del metabolismo cerebral (Ogoh, Dalsgaard, et al., 2005) .
Si la perfusión disminuye independientemente de la PaCO2, frente a estímulos potentes que tienden a incrementarla, esto indicaría que son otros mecanismos los que deben ejercer el efecto regulador principal. La clave podría encontrarse en los cambios en la resistencia vascular inducida por mecanismos neurogénicos y miogénicos. Los efectos del sistema nervioso simpático (SNS) sobre la circulación cerebral siguen generando controversia, pero es evidente que durante el esprint su actividad debe ser elevada, incrementando la PAM y el GC. De hecho, el índice cerebrovascular se incrementa entre el reposo y el ejercicio confirmando la excitación simpática (Ide et al., 2000) . Más aún, disminuciones de GC inducidas por bloqueadores β1 conllevan una reducción del ascenso en la vACM (Ide et al., 2000) . Sin embargo, la activación inducida de los barorreceptores no parece influenciar la respuesta cerebral al CCO2 (LeMarbre et al., 2003), a pesar de que existe una relación directa entre la presión arterial y el FSC (Lucas et al., 2010) . A altas intensidades se observa que el FSC desciende, por lo que necesariamente existe un mecanismo compensador que optimiza el control de la perfusión cerebral (Ide et al., 2000) o mecanismos desconocidos que modifican la relación entre ambos parámetros (Ogoh, Brothers, et al., 2005) .
Estudios en animales han registrado un incremento de la actividad simpática ante hipertensiones inducidas (Cassaglia, Griffiths, & Walker, 2008) y ésta presenta la capacidad de generar vasoconstricción sobre las arterias, lo que junto con la respuesta miogénica posee el potencial de frenar el incremento del FSC (Hamner, Tan, Lee, Cohen, & Taylor, 2010). A pesar de resultar una explicación razonable, los mismos estudios muestran que un 38% de la relación presión/flujo permanece inexplicada en reposo, únicamente atendiendo a estos dos mecanismos (Hamner et al., 2010). La implicación de las arterias carótidas y vertebrales en la regulación del FSC vía activación del SNS, es una propuesta que debe ser considerada atentamente. Diversos estudios proponen que debido a su configuración tortuosa a nivel de su entrada en el cráneo, relativamente pequeñas disminuciones de su diámetro podrían generar grandes incrementos de la resistencia vascular, limitando de esta forma la transmisión de los incrementos de presión sanguínea (Schubert et al., 2011). Estos efectos neurogénicos y de las paredes vasculares, a pesar de la controversia que generan, cada vez están siendo tomados en mayor consideración, y son probablemente los efectos predominantes en nuestras condiciones experimentales, fundamentalmente por la rapidez de actuación ante cambios rápidos en la presión de perfusión y el flujo (Harder, Roman, Gebremedhin, Birks, & Lange, 1998). Sin embargo, su contribución relativa requiere mayor investigación, así como la localización de sus efectos (arterias piales, las arterias vertebrales o la arteria carótida interna).
Hay una serie de condiciones por las que entendemos que existen pocas dudas en cuanto a los resultados obtenidos hasta el momento. En primer lugar hemos realizado medidas mediante la colocación de dos sondas Doppler a cada lado del cráneo, obteniendo resultados similares en ambas arterias cerebrales medias. Por otro lado, los valores de reposo obtenidos a lo largo del estudio se corresponden con los valores publicados por otros autores (Rasmussen, Stie, Nielsen, & Nybo, 2006) . Finalmente, al finalizar los esprint la velocidad de la ACM se recuperó hacia valores similares a los observados en reposo, permitiéndonos descartar artefactos causados por el desplazamiento de las sondas. Otro aspecto destacable de nuestro estudio, se basa en la doble comprobación realizada mediante NIRS. La respuesta obtenida en los valores de TOI es similar a la comunicada en otros estudios, lo que nos reafirma en el adecuado funcionamiento y captación de la señal (Rasmussen et al., 2007) . El buen funcionamiento del equipo de NIRS queda también constatado observando el descenso esperado del TOI del Vastus lateralis durante los esprints. Aunque es cierto, que el aumento del GC genera un aumento global de la perfusión y, por tanto de la circulación músculo-cutánea de la cara y el cráneo (Rasmussen et al., 2007) , debido también al aumento de la temperatura durante el ejercicio (Davis, Fadel, Cui, Thomas, & Crandall, 2006). Podríamos haber aplicado algoritmos que han sido desarrollados a fin de eliminar el efecto de la circulación cutánea (Hirasawa et al., 2016) , pero los resultados, sólo hubieran sido ligeramente inferiores.
En resumen, los experimentos que hemos llevado a cabo han demostrado que es posible medir la velocidad de la sangre de las arterias cerebrales medias mediante doppler transcraneal de forma bilateral durante el ejercicio de esprint en seres humanos, para estimar los cambios que experimenta la perfusión cerebral. Combinando las señales del doppler con espectroscopía cercana al infrarrojo hemos demostrado que durante el ejercicio de esprint disminuye el flujo sanguíneo cerebral, a pesar del importante incremento de la presión arterial media. Este descenso del flujo sanguíneo cerebral demuestra que los mecanismos de autoregulación se oponen eficazmente a la hiperperfusión que podría provocar el aumento de la presión arterial, con el consiguiente riesgo para la integridad de la membrana hematoencefálica. Nuestros datos indican que el descenso del FSC durante el ejercicio de esprint es funcionalmente irrelevante en jóvenes sanos, con muy escasa repercusión en la oxigenación cerebral. No obstante, la realización de esfuerzos de esprint repetidos induce cambios mayores, que podrían tener más trascendencia sobre la oxigenación cerebral. Dado el interés que existe en la actualidad en el ejercicio de alta intensidad como procedimiento para inducir adaptaciones rápidas al entrenamiento, es importante continuar estos estudios y determinar hasta qué punto el ejercicio de esprint de alta intensidad no entraña riesgo para la integridad de la circulación cerebral o la oxigenación cerebral.
Referencias
2. Aaslid, R., Lindegaard, K. F., Sorteberg, W., & Nornes, H. (1989). Cerebral autoregulation dynamics in humans. Stroke, 20(1), 45-52.
3. Ainslie, P. N., & Duffin, J. (2009). Integration of cerebrovascular CO2 reactivity and chemoreflex control of breathing: mechanisms of regulation, measurement, and interpretation. Am J Physiol Regul Integr Comp Physiol, 296(5), R1473-1495. doi:10.1152/ajpregu.91008.2008
4. Ainslie, P. N., & Ogoh, S. (2010). Regulation of cerebral blood flow in mammals during chronic hypoxia: a matter of balance. Exp Physiol, 95(2), 251-262. doi:10.1113/expphysiol.2008.045575
5. Burgomaster, K. A., Howarth, K. R., Phillips, S. M., Rakobowchuk, M., Macdonald, M. J., McGee, S. L., & Gibala, M. J. (2008). Similar metabolic adaptations during exercise after low volume sprint interval and traditional endurance training in humans. J Physiol, 586(1), 151-160. doi:jphysiol.2007.142109 [pii]10.1113/jphysiol.2007.142109
6. Calbet, J. A., & Lundby, C. (2012). Skeletal muscle vasodilatation during maximal exercise in health and disease. J Physiol, 590(Pt 24), 6285-6296. doi:10.1113/jphysiol.2012.241190
7. Calbet, J. A., Mortensen, S. P., Munch, G. D., Curtelin, D., & Boushel, R. (2016). Constant infusion transpulmonary thermodilution for the assessment of cardiac output in exercising humans. Scand J Med Sci Sports, 26(5), 518-527. doi:10.1111/sms.12473
8. Cassaglia, P. A., Griffiths, R. I., & Walker, A. M. (2008). Sympathetic nerve activity in the superior cervical ganglia increases in response to imposed increases in arterial pressure. Am J Physiol Regul Integr Comp Physiol, 294(4), R1255-1261. doi:10.1152/ajpregu.00332.2007
9. Davies, C. T., Di Prampero, P. E., & Cerretelli, P. (1972). Kinetics of cardiac output and respiratory gas exchange during exercise and recovery. J Appl Physiol, 32(5), 618-625.
10. Davis, S. L., Fadel, P. J., Cui, J., Thomas, G. D., & Crandall, C. G. (2006). Skin blood flow influences near-infrared spectroscopy-derived measurements of tissue oxygenation during heat stress. J Appl Physiol (1985), 100(1), 221-224. doi:10.1152/japplphysiol.00867.2005
11. Deegan, B. M., Devine, E. R., Geraghty, M. C., Jones, E., Olaighin, G., & Serrador, J. M. (2010). The relationship between cardiac output and dynamic cerebral autoregulation in humans. J Appl Physiol (1985), 109(5), 1424-1431. doi:10.1152/japplphysiol.01262.2009
12. Gillen, J. B., & Gibala, M. J. (2014). Is high-intensity interval training a time-efficient exercise strategy to improve health and fitness? Appl Physiol Nutr Metab, 39(3), 409-412. doi:10.1139/apnm-2013-0187
13. Hamner, J. W., Tan, C. O., Lee, K., Cohen, M. A., & Taylor, J. A. (2010). Sympathetic control of the cerebral vasculature in humans. Stroke, 41(1), 102-109. doi:10.1161/STROKEAHA.109.557132
14. Harder, D. R., Roman, R. J., Gebremedhin, D., Birks, E. K., & Lange, A. R. (1998). A common pathway for regulation of nutritive blood flow to the brain: arterial muscle membrane potential and cytochrome P450 metabolites. Acta Physiol Scand, 164(4), 527-532.
15. Hermansen, L., & Vaage, O. (1977). Lactate disappearance and glycogen synthesis in human muscle after maximal exercise. Am J Physiol, 233(5), E422-429.
16. Hirasawa, A., Kaneko, T., Tanaka, N., Funane, T., Kiguchi, M., Sorensen, H., . . . Ogoh, S. (2016). Near-infrared spectroscopy determined cerebral oxygenation with eliminated skin blood flow in young males. J Clin Monit Comput, 30(2), 243-250. doi:10.1007/s10877-015-9709-4
17. Huang, S. C., Wong, M. K., Lin, P. J., Tsai, F. C., Fu, T. C., Wen, M. S., . . . Wang, J. S. (2014). Modified high-intensity interval training increases peak cardiac power output in patients with heart failure. Eur J Appl Physiol, 114(9), 1853-1862. doi:10.1007/s00421-014-2913-y
18. Ide, K., Boushel, R., Sorensen, H. M., Fernandes, A., Cai, Y., Pott, F., & Secher, N. H. (2000). Middle cerebral artery blood velocity during exercise with beta-1 adrenergic and unilateral stellate ganglion blockade in humans. Acta Physiol Scand, 170(1), 33-38. doi:10.1046/j.1365-201x.2000.00757.x
19. Ide, K., Eliasziw, M., & Poulin, M. J. (2003). Relationship between middle cerebral artery blood velocity and end-tidal PCO2 in the hypocapnic-hypercapnic range in humans. J Appl Physiol (1985), 95(1), 129-137.
20. Lacewell, A. N., Buck, T. M., Romero, S. A., & Halliwill, J. R. (2014). Postexercise syncope: Wingate syncope test and effective countermeasure. Exp Physiol, 99(1), 172-186. doi:10.1113/expphysiol.2013.075333
21. Lassen, N. A. (1959). Cerebral blood flow and oxygen consumption in man. Physiol Rev, 39(2), 183-238.
22. LeMarbre, G., Stauber, S., Khayat, R. N., Puleo, D. S., Skatrud, J. B., & Morgan, B. J. (2003). Baroreflex-induced sympathetic activation does not alter cerebrovascular CO2 responsiveness in humans. J Physiol, 551(Pt 2), 609-616. doi:10.1113/jphysiol.2003.046987
23. Losa-Reyna, J., Torres-Peralta, R., Henriquez, J. J., & Calbet, J. A. (2015). Arterial to end-tidal Pco2 difference during exercise in normoxia and severe acute hypoxia: importance of blood temperature correction. Physiol Rep, 3(10). doi:10.14814/phy2.12512
24. Lucas, S. J., Tzeng, Y. C., Galvin, S. D., Thomas, K. N., Ogoh, S., & Ainslie, P. N. (2010). Influence of changes in blood pressure on cerebral perfusion and oxygenation. Hypertension, 55(3), 698-705. doi:10.1161/HYPERTENSIONAHA.109.146290
25. Mardimae, A., Balaban, D. Y., Machina, M. A., Battisti-Charbonney, A., Han, J. S., Katznelson, R., . . . Duffin, J. (2012). The interaction of carbon dioxide and hypoxia in the control of cerebral blood flow. Pflugers Arch, 464(4), 345-351. doi:10.1007/s00424-012-1148-1
26. Moraine, J. J., Lamotte, M., Berre, J., Niset, G., Leduc, A., & Naeije, R. (1993). Relationship of middle cerebral artery blood flow velocity to intensity during dynamic exercise in normal subjects. Eur J Appl Physiol Occup Physiol, 67(1), 35-38.
27. Nogueira, R. C., Bor-Seng-Shu, E., Santos, M. R., Negrao, C. E., Teixeira, M. J., & Panerai, R. B. (2013). Dynamic cerebral autoregulation changes during sub-maximal handgrip maneuver. PLoS One, 8(8), e70821. doi:10.1371/journal.pone.0070821
28. Ogoh, S., & Ainslie, P. N. (2009). Cerebral blood flow during exercise: mechanisms of regulation. J Appl Physiol (1985), 107(5), 1370-1380. doi:00573.2009 [pii]10.1152/japplphysiol.00573.2009
29. Ogoh, S., Brothers, R. M., Barnes, Q., Eubank, W. L., Hawkins, M. N., Purkayastha, S., . . . Raven, P. B. (2005). The effect of changes in cardiac output on middle cerebral artery mean blood velocity at rest and during exercise. J Physiol, 569(Pt 2), 697-704. doi:10.1113/jphysiol.2005.095836
30. Ogoh, S., Dalsgaard, M. K., Yoshiga, C. C., Dawson, E. A., Keller, D. M., Raven, P. B., & Secher, N. H. (2005). Dynamic cerebral autoregulation during exhaustive exercise in humans. Am J Physiol Heart Circ Physiol, 288(3), H1461-1467. doi:00948.2004 [pii]10.1152/ajpheart.00948.2004
31. Querido, J. S., & Sheel, A. W. (2007). Regulation of cerebral blood flow during exercise. Sports Med, 37(9), 765-782. doi:3792 [pii]
32. Rasmussen, P., Dawson, E. A., Nybo, L., van Lieshout, J. J., Secher, N. H., & Gjedde, A. (2007). Capillary-oxygenation-level-dependent near-infrared spectrometry in frontal lobe of humans. J Cereb Blood Flow Metab, 27(5), 1082-1093. doi:9600416 [pii]10.1038/sj.jcbfm.9600416
33. Rasmussen, P., Stie, H., Nielsen, B., & Nybo, L. (2006). Enhanced cerebral CO2 reactivity during strenuous exercise in man. Eur J Appl Physiol, 96(3), 299-304. doi:10.1007/s00421-005-0079-3
34. Rokamp, K. Z., Olesen, N. D., Larsson, H. B., Hansen, A. E., Seifert, T., Nielsen, H. B., . . . Rostrup, E. (2014). Glycopyrrolate does not influence the visual or motor-induced increase in regional cerebral perfusion. Front Physiol, 5, 45. doi:10.3389/fphys.2014.00045
35. Sakamoto, A., Naito, H., & Chow, C. M. (2014). Hyperventilation as a strategy for improved repeated sprint performance. J Strength Cond Res, 28(4), 1119-1126. doi:10.1519/JSC.0b013e3182a1fe5c
36. Schubert, T., Santini, F., Stalder, A. F., Bock, J., Meckel, S., Bonati, L., . . . Wetzel, S. (2011). Dampening of blood-flow pulsatility along the carotid siphon: does form follow function? AJNR Am J Neuroradiol, 32(6), 1107-1112. doi:10.3174/ajnr.A2426
37. Stefanelli, F., Meoli, I., Cobuccio, R., Curcio, C., Amore, D., Casazza, D., . . . Rocco, G. (2013). High-intensity training and cardiopulmonary exercise testing in patients with chronic obstructive pulmonary disease and non-small-cell lung cancer undergoing lobectomy. Eur J Cardiothorac Surg, 44(4), e260-265. doi:10.1093/ejcts/ezt375
38. Yamaguchi, Y., Kashima, H., Fukuba, Y., & Hayashi, N. (2014). Cerebral blood flow and neurovascular coupling during static exercise. J Physiol Sci, 64(3), 195-201. doi:10.1007/s12576-014-0311-1
Cita en Kronos
David Curtelin, Mario Perez-Valera, Marcos Martin-Rincon, Ismael Pérez-Suárez, Evgenia D. Cherouveim, Rafael Torres-Peralta, José A. L. Calbet David Morales-Alamo (2016). Flujo Sanguíneo Cerebral Durante el Ejercicio de Esprint. . (2).https://g-se.com/flujo-sanguineo-cerebral-durante-el-ejercicio-de-esprint-2196-sa-5585c22a1cec5d
This post is also available in: Inglés
